個別化医療は、遺伝情報や体質に基づいて治療・予防を最適化する新しい医療の在り方です。治療効果の向上や副作用の軽減といったメリットが注目される一方で、費用や倫理面のデメリットや医療格差の問題も議論されています。
また、個別化医療の具体事例を通じて、誰もが公平に医療を受けられる未来の可能性と課題を多角的に探ります。医療の選択肢が広がる今、自分自身の健康とどう向き合うかを考えてみましょう。
目次
個別化医療とは

個別化医療とは、患者一人ひとりの遺伝情報(ゲノム)や体質、生活環境に基づいて、最も効果的で副作用の少ない治療法や予防法を提供する医療アプローチです。
従来の「平均的な患者」を想定した標準治療から、「あなた自身」に最適化された医療へ。この根本的な発想の転換が、医療の未来を大きく変えようとしています。
個別化医療は単なる技術革新ではなく、一人ひとりの命と尊厳をより深く尊重する医療の在り方そのものです。では、この個別化医療とは具体的にどのような医療なのでしょうか。
個別化医療の定義
個別化医療は、患者の遺伝子やタンパク質、生活環境などの情報を科学的に解析し、その人固有の特性に基づいて病気の予防や治療を行うアプローチです。具体的には、患者の体質や病気に関連する遺伝子やタンパク質をより詳細に調べた上で、個々の患者の体質や病気のタイプに合わせて治療を行います。
この医療は「パーソナライズド・メディシン(Personalized Medicine)」とも呼ばれ、「オーダーメイド医療」「テーラーメイド医療」とも表現されることもあります。また、「プレシジョン・メディシン(Precision Medicine:精密医療)」という用語も使われ、2015年に米国で国家プロジェクトとして提唱されて以降、世界的に広まりました。
プレシジョン・メディシン(Precision Medicine:精密医療)
プレシジョン・メディシンは、遺伝子情報、生活環境、ライフスタイルにおける個々人の違いを考慮して疾病予防や治療を行う考え方です。ゲノム情報などに基づき患者を細かく分類(層別化)し、そのグループごとに最も効果的な治療法を精密に選ぶことを目指します。
現在、個別化医療という言葉は、この精密医療の意味も含めて広く使われています。
個別化医療が注目される背景
個別化医療が注目される背景には、以下の二つの大きな理由があります。
- 病気の発症や進行に特定の遺伝子が強く関わっている場合があることが分かった
- 遺伝子を調べる検査技術や、遺伝子の異常に対する治療薬の開発が進んだ
従来の医療では、同じ病気と診断され同じ治療を受けても、患者によって治療の効果や副作用の現れ方に個人差がありました。近年の研究により、このような治療効果の個人差には患者の病気と関係する遺伝子が関わっていることが分かってきました。
国際プロジェクト「ヒトゲノム計画」
特に重要な転機となったのが、1990年に始まり2003年に完了宣言が出された国際プロジェクト「ヒトゲノム計画」です。この13年にわたるプロジェクトにより、ヒトの全遺伝情報が解読され、個別化医療の実現に向けた基盤が築かれました。
その後の技術革新により、2025年現在では一人分のDNA配列の解析が約2週間で可能になっています。さらに、AI技術の進化により、大量のゲノム情報を効率的に解析し、疾患発症リスク評価を支援するなど、個別化医療の実現が加速しています。
個別化医療の基本的な仕組み
個別化医療では、治療を始める前に遺伝子などを検査して患者の病気のタイプを調べ、効果がより高いと期待できる薬を投与します。その中核となるのが「バイオマーカー」と呼ばれる生体内の目印です。
バイオマーカーによる分子プロファイリング
バイオマーカーとは、病気の状態や特定の薬に対する反応性を示す生体内の目印となる物質(特定の遺伝子変異やタンパク質など)を指します。患者から採取した組織や血液を用いて遺伝子検査を実施し、このバイオマーカーの有無を詳しく調べる「分子プロファイリング」が行われます。
検査結果から特定のバイオマーカーが見つかれば、それに対応した分子標的治療薬を選択します。このバイオマーカーの有無を調べる検査が「コンパニオン診断」です。
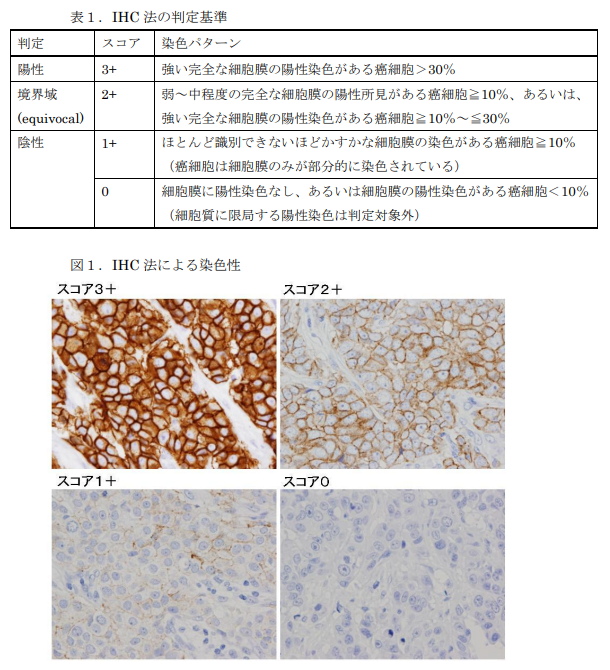
例えば、乳がん治療薬トラスツズマブを使用する前には、必ずHER2タンパク質の発現を調べるHER2検査を実施します。この検査で陽性と判定された患者にのみ、トラスツズマブが効果を発揮するためです。
従来の検査が病名を確定するためであったのに対し、コンパニオン診断はどの薬が最適かを選択するための検査であり、治療決定そのものに直結します。
【乳癌細胞の膜における染色性およびその染色強度を対称としたHER2検査の例】
近年では、組織採取が困難な患者でも遺伝子解析が可能な「リキッドバイオプシー(血液検査)」の技術も発展しています。
個別化医療の対象となる主な疾患
現在、個別化医療は特にがんの領域で研究が進んでいます。がんは遺伝子が変化してがん細胞となり増殖する病気であり、どの遺伝子に変異が起こるかは患者ごとに異なっています。
肺がんでは、EGFR、ALK、ROS1※といった遺伝子の異常を標的とした治療が確立されており、先述の乳がんでは、HER2タンパク質が過剰に発現するタイプに対する分子標的薬が、患者の生存率を劇的に向上させました。
がん以外では、薬物代謝酵素の遺伝子多型を調べることで、薬の効果や副作用を事前に予測する取り組みが進んでいます。精神疾患治療においても、遺伝子変異が抗うつ薬や抗精神病薬への反応性に影響することが明らかになっています。
さらに、希少疾患や難病の分野でも個別化医療は大きな希望となっており、これまで診断がつかずに苦しんでいた患者に対し、ゲノム解析技術により正確な診断と治療の道を開く可能性が示されています。
このように個別化医療は、がんから希少疾患まで幅広い領域で実用化が進んでおり、多くの人にとって近い将来、現実的な医療の選択肢となりつつあります。*1)
個別化医療とこれまでの医療との違い

「同じ病気と診断されたのに、なぜ治療効果に差が出るのか?」
この長年の疑問に、個別化医療は答えを示しつつあります。従来の医療は統計データに基づき「平均的な患者」に最善とされる治療を行ってきましたが、個別化医療は一人ひとりの違いに注目します。
ここでは、標準治療との比較、診断・選択プロセスの変化、効果と介入の焦点、そして「オーダーメイド医療」との違いを解説します。
治療の基盤:「集団」から「個」への転換
従来の「標準治療」は、多数の臨床試験で得られた科学的証拠(エビデンス)をもとに、同じ病気・ステージの患者全員に推奨される治療法でした。しかし効果や副作用には個人差があります。
個別化医療は、遺伝子や分子レベルで患者を層別化し、最適解を探る点が根本的に異なります。
診断と治療選択のプロセス:分子情報の重視
従来は症状や画像診断、病理検査で病名・ステージを確定し、ガイドラインに従って治療を決定していました。個別化医療では「分子プロファイリング」を導入し、組織・血液からバイオマーカー(特定の遺伝子変異やタンパク質)を同定します。
コンパニオン診断により、このバイオマーカーの有無を調べ、その患者個人への効果や副作用を予測して最適な薬を選ぶための検査を行います。
効果と介入の焦点:効率化・副作用軽減・予防への展開
「SCRUM-Japan MONSTARプロジェクト」※では、従来の治療による「病気が進まない期間」の中央値が15.3か月であったのに対し、個別化医療による治療を受けた患者のの中央値は19.1か月と、約3.8か月長いことが確認されました。また、分子標的薬は正常な細胞へのダメージを抑えるため、つらい副作用を減らすことができます。
さらに、遺伝子情報から将来かかりやすい病気のリスクを調べることで、病気になる前に予防や早期発見・治療ができるようになってきました。
「オーダーメイド医療」との違い
「オーダーメイド医療」は多くの場合「個別化医療」と同義の言葉として使われますが、文字通り服を仕立てるように、究極的に「その人ただ一人」のために治療法を設計するというニュアンスを持ちます。一方で、現在の「個別化医療(プレシジョン・メディシン)」は、患者を遺伝情報などで精密な「グループ(層)」に分類し、そのグループごとに最適な既存の治療法を選択する「層別化医療」としてのアプローチが主流です。
どちらも個人の特性に着目する点は共通していますが、対応する単位が究極の個か精密なグループかという点で、使い分けることもあります。
個別化医療は、従来の「平均的患者向け治療」から「一人ひとりの特性に応じた治療」へと医療の常識を根本から変えています。次の章では、具体的な疾患領域での活用事例を見ていきましょう。*2)
個別化医療の具体事例
現在、個別化医療は特にがん治療の領域で臨床現場に導入され、患者さんの生存期間延長や副作用軽減、生活の質向上に大きく貢献しています。さらに薬剤応答性の予測や希少疾患への対応など、その応用範囲は急速に広がりつつあります。
個別化医療が具体的にどう実践されているか、代表的な三つの領域から成功事例を紹介します。
①がん治療における分子標的治療薬の成功例
がん領域は個別化医療の進展が最も著しい分野です。がんの発生や増殖の根本原因となる遺伝子変異(ドライバー遺伝子)を特定し、そこだけを狙い撃ちする「分子標的薬」の開発が飛躍的に進みました。
例えば、肺がんでは、EGFR、ALK、ROS1といったドライバー遺伝子の異常を標的とした治療が確立されています。特にEGFR遺伝子変異を持つ患者に対する分子標的薬オシメルチニブ(商品名:タグリッソ)は優れた効果を示し、「FLAURA(フローラ)試験」という大規模な臨床研究で、薬の効果が比べられました。
この試験では「がんが悪化し始めるまでの期間」を調べたところ、その期間の中央値が、この分子標的薬では18.9か月でした。これは、これまでの標準的な薬を使った場合の10.2か月と比べて、がんの進行を大幅に長く抑えられたことを示しています。
乳がんにおいては、HER2タンパク質が過剰に発現するタイプ(HER2陽性)に対する分子標的薬トラスツズマブ(商品名:ハーセプチン)の登場が、生存率が低いとされていたHER2陽性乳がんの治療成績を劇的に改善させました。
日本では国立がん研究センター中心の産学連携プロジェクトSCRUM-Japanが大きな成果を上げています。2015年開始以来、全国の医療機関から約3万例の組織遺伝子検査と約1万例のリキッドバイオプシー(血液検査)を実施し、希少な遺伝子変異を持つ患者を特定することで最適な新薬の治験につなげてきました。その結果、2024年9月時点で新薬20剤27適応と診断薬16種が薬事承認され、全国の患者に新たな治療選択肢を届けています。
②薬剤応答性と副作用予測への応用
個別化医療はがん以外の分野にも広がっています。同じ薬を同じ量使用しても効果や副作用の出方が人により大きく異なる背景に、薬の代謝(分解・排出)に関わる酵素の遺伝的違い(遺伝子多型)が関与していることが解明されています。
例えば、鎮痛薬「トラマドール」は体内のCYP2D6という酵素により活性化され効果を発揮します。しかし、この酵素の働きが遺伝的に弱い人では効果が減弱する可能性があり、代替薬の検討や投与量調整が考慮されます。
また、重篤な副作用回避にも遺伝子検査は有用です。抗がん剤フルオロウラシル(5-FU)はDPYD酵素により分解されますが、この酵素の働きが生まれつき弱い人に投与すると重い副作用(骨髄抑制など)を引き起こすことが判明しており、事前の遺伝子検査で投与量を減らす、または別の薬を選択する対応が可能になります。
2025年10月には東北大学と国立循環器病研究センターが薬物代謝酵素CYP2E1の遺伝子のさまざまな違い(多型)が、体内でどのような働きをするかを全て調べることに成功し、薬物代謝の個人差をより精密に評価できるようになり、個別化医療へのさらなる応用が期待されています。
③希少疾患に対する究極の個別化治療:N-of-1
N-of-1(エヌ・オブ・ワン)という言葉は、文字通り「たった一人の患者のため」だけに治療法を開発する、個別化医療の究極形です。これは、先ほど触れた「オーダーメイド医療」とも関連しますが、完全に同じではなく、これは、たった一人の患者だけを対象にして行う、特別な臨床試験(治療の効果を試す研究)のやり方(デザイン)です。
米国では2018年、ハーバード医科大学のTimothy Yu博士らが進行性希少疾患「バッテン病」※に罹患した当時7歳の女児のために、その子固有の遺伝子変異だけを標的とする核酸医薬※「ミランセン」を開発しました。
多くの専門家の協力により、わずか1年足らずで開発から臨床投与に至ったこの事例は、世界に大きな衝撃を与えました。
日本でも希少疾患の患者は決して少なくありません。個々の疾患の患者数は少ないものの、対象疾患数は約7,000種類にのぼり、国内には約600万人の希少疾患に該当する患者がいると推定されています。核酸医薬やゲノム編集技術などを応用し、個々の患者の遺伝情報に基づいた治療法を迅速に開発・提供する「日本版N-of-1創薬」の実現に向け、日本医療研究開発機構(AMED)などを中心に研究開発が進められています。
診断はできても有効な治療法がなかった患者にとって、個別化医療はまさに希望の光となりつつあります。
個別化医療はがんのような患者数の多い疾患から希少疾患、さらには日常的な薬剤反応性の予測まで、幅広い領域で着実に実用化が進んでいます。次の章では、個別化医療のメリットを確認します。*3)
個別化医療のメリット

個別化医療がもたらす恩恵は、特定の病気に対する治療効果の向上に留まりません。
- 患者一人ひとりの生活の質(QOL)の向上
- 医療システム全体の効率化
- 未来の健康を守る予防医療の実現
など、そのメリットは非常に多岐にわたっています。具体的に見ていきましょう。
治療効果の最大化と生存期間の延長
個別化医療がもたらす最大のメリットは、その患者に最も効果が期待できる治療法を高い精度で選択できる点です。従来の画一的な治療では、効果が乏しい可能性のある治療を試さざるを得ない場合もありました。
事前に遺伝子検査などでバイオマーカー(治療薬の目印となる分子)を特定することにより、その目印に適合する治療薬をピンポイントで選択できます。SCRUM-Japan MONSTARプロジェクトの研究では、バイオマーカーに適合する標的治療を受けた患者の生存期間中央値が19.1か月であったのに対し、適合する治療を受けなかった患者は15.3か月であり、死亡リスクが23%低下しました。
特に、リキッドバイオプシー(血液検査)を用いたGOZILAプロジェクト※では、標的治療を受けた患者群の生存期間中央値が18.6か月、受けなかった患者群は9.9か月と、約2倍の差が確認されており、その有効性が実証されています。効果が期待できる薬剤を事前に絞り込めるため、合わないかもしれない治療をいくつも試すことなく、初めから自分に合った方法で治療を行える点が大きなメリットです。
副作用の軽減と安全性の向上
治療の安全性向上も個別化医療の重要なメリットです。従来の抗がん剤(化学療法)は、がん細胞だけでなく分裂の速い正常な細胞(髪の毛、口内粘膜、血液細胞など)にもダメージを与え、強い副作用の原因となることが少なくありませんでした。
それに対し、分子標的薬は特定のバイオマーカーを持つがん細胞を選んで攻撃するよう設計されているため、正常な細胞への影響が比較的少なく、副作用の軽減が期待できます。また、薬理遺伝学(ファーマコゲノミクス)の進歩により、薬の代謝(分解・排出)に関わる遺伝的な体質の違いも解明されつつあります。
これにより患者の身体的・精神的な苦痛を大幅に軽減し、治療の安全性を高めることが可能です。
医療の効率化と早期の社会復帰
効果が高く副作用の少ない治療が可能になれば、治療期間の短縮や、入院ではなく通院での治療継続が期待できます。これにより、患者が治療を受けながらでも仕事や日常生活を続けやすくなり、早期の社会復帰を後押しします。
また、患者本人だけでなく、家族や周囲でサポートする人たちの精神的・経済的な負担軽減にも直結します。
医療システム全体から見ても、個別化医療は大きなメリットをもたらします。効果が見込めない治療の「空振り」を減らし、無駄な薬剤費や入院費といった医療資源の浪費を避けることができます。
米国の試算では、個別化医療の適用により、トラスツズマブで患者一人当たり年間4万ドル、イマチニブで8万ドル、ワルファリンで2千ドルの医療費削減が期待できるとされています。治療期間が短縮されることで精神的・経済的な負担も少なくなり、患者の生活の質の維持にもつながります。
予防医療への展開と早期発見
個別化医療の真価は、すでに発症した病気を治すことだけに留まりません。むしろ、病気になる前の段階で介入する予防医療や先制医療への道を開く点に、その革新性があります。
個人のゲノム情報を詳細に解析することで、将来特定のがんや生活習慣病(糖尿病、高血圧など)にかかりやすい「疾患リスク」を、発症する前に高い精度で予測することが可能になってきました。特定の疾患リスクが高いと判明した場合、より重点的な生活習慣(食事、運動)の改善指導を行ったり、通常よりも頻繁かつ高精度な検診を実施したりすることで、発症そのものを防ぐ、あるいは万が一発症しても超早期の段階で発見し、負担の少ない治療で介入できます。
たとえば糖尿病のリスクが高い人は糖質を控えた食事や定期的な運動、がんリスクが高い人は禁煙や適度な飲酒、バランスの取れた食事が推奨されます。リスクが高いと分かった人は定期的な健康診断を受けることで早期発見が可能になり、初期段階での治療につながります。
このように個別化医療は多面的なメリットを持ち、患者と社会の双方に恩恵をもたらします。次の章では、こうしたメリットの裏側にあるデメリットや課題、限界についても冷静に見ていきましょう。*4)
個別化医療のデメリット・課題

前章で見たように、個別化医療は患者さんや社会に多大な恩恵をもたらす可能性を秘めています。しかしその一方で、この新しい医療アプローチが広く普及し、誰もがその恩恵を平等に受けられるようになるまでには、乗り越えなければならない多くの現実的な課題が存在します。
ここでは、個別化医療の普及と定着を妨げる代表的な課題を考察します。
高額なコストと経済的格差
個別化医療の実現と普及を阻む最も大きな障壁の一つが、その高額な費用です。ゲノム解析技術は飛躍的に進歩したとはいえ、がんの網羅的な遺伝子情報を調べる「がん遺伝子パネル検査」は依然として高額な検査です。
日本の現状では、保険適用される場合でも56万円の検査費用がかかり、3割負担の患者でも約17万円の自己負担が必要です。保険適用されない期間※に受ける場合は全額自己負担となり、検査によって40万円から100万円と高額になります。
さらに、分子標的薬や免疫チェックポイント阻害薬といった新薬の多くは、開発に莫大なコストがかかっており、薬価も極めて高額になる傾向があります。
高額療養費制度があるとはいえ、患者の窓口負担は重くなりがちで、経済力によって受けられる医療の質や選択肢に差が生じてしまう医療アクセス格差が深刻化するのではないかという懸念が強く指摘されています。
※保険適用されない期間
がん遺伝子パネル検査を保険で受けるための条件(ルール)を満たしていないタイミングのこと。がん遺伝子パネル検査の保険適用には「標準治療(手術・抗がん剤・放射線治療など)が終了した後」という条件があり、診断直後や治療中にこの検査を受けたい場合、その時点ではルール上保険の対象外となるため、検査費用は全額自己負担(40~100万円)となる。
遺伝情報の取り扱いと倫理的・法的・社会的課題(ELSI)
個別化医療の基盤となるゲノム(遺伝)情報は「究極の個人情報」とも呼ばれ、その取り扱いには極めて慎重な配慮と厳格なルールが必要です。ゲノム情報からは、現在かかっている病気の状態だけでなく、将来発症しうる他の病気のリスクや、さらには血縁者(家族)の遺伝的な特徴まで推測できてしまう可能性があるためです。
個別化医療には、こうした機微な情報が本人の意図しない形で漏洩したり、不適切に利用されたりするリスクが伴います。就職や生命保険への加入といった社会生活の場面で、遺伝情報に基づいて不当な差別(ジェネティック・ディスクリミネーション)が行われる可能性が懸念されています。
また、検査によって治療法が確立されていない病気のリスクが判明した場合、患者に過度な心理的負担を与える可能性もあります。
このような個別化医療の進展に伴って生じる倫理的(Ethical)・法的(Legal)・社会的(Social)な課題は、その頭文字をとって「ELSI(エルシー)」と呼ばれ、技術開発と並行してこれらの課題に対応していくことが国際的に極めて重要視されています。個人情報保護の観点からは、遺伝情報を扱う施設のセキュリティや、データを扱う専門家の育成なども社会的な課題といえます。
検査・治療における技術的限界と時間的制約
優れた検査技術や治療薬が存在していても、それがすべての患者に恩恵をもたらすわけではないという技術的な限界も存在します。がん遺伝子パネル検査を受けたとしても、実際に有効な治療薬(適合するバイオマーカー)が見つかり治療に結びつく患者は、まだ全体の一部に限られているという現実があります。
また、遺伝子や特定の物質に対する異常について情報が得られたとしても、対応できる治療方法が承認されていなかったり、薬剤を投与する条件に当てはまらなかったりすることもあります。特に希少疾患や新たに見つかった遺伝子変異に対しては薬剤開発が追いついておらず、治療選択肢が極めて限られているケースも少なくありません。
個別化医療の検査には時間もかかります。1回の検査で数十から数百個の遺伝子を解析する場合、診断が下りるまでに1か月半から2か月ほどの時間を要します。
病状によっては遺伝子解析の結果が出る前に悪化してしまい、個別化医療を活かした治療を受けられないこともあるのです。さらに、治験薬を海外から個人輸入する場合は薬剤を取り寄せるまでに2から4週間程度の時間がかかり、治療開始までにより長い時間を要します。
医療提供体制と専門人材の不足
個別化医療を安全かつ適切に実施するためには、高度な専門知識を持つ人材と、それを支える医療体制が必要ですが、現状ではその両方が不足しています。
膨大なゲノム情報を医学的に正確に解釈し最適な治療方針を導き出すためには、
- 臨床遺伝専門医:遺伝性疾患の診断や遺伝カウンセリングを行い、ゲノム情報を臨床的に解釈して患者に最適な治療方針を提示する医師。
- 病理医:組織や細胞を顕微鏡で詳細に調べ、がんの種類や性質を診断し、遺伝子検査に適した検体を選定する医師。
- バイオインフォマティシャン(生命情報科学の専門家):膨大なゲノムデータをコンピュータやAIを用いて解析し、病気に関連する遺伝子変異を特定する専門家。
- 認定遺伝カウンセラー:遺伝検査の結果や意味を患者や家族に分かりやすく説明し、心理的サポートや意思決定の支援を行う専門職。
など、高度な専門知識を持つ人材が欠かせません。
現状では、高度な医療を提供できるがんゲノム医療中核拠点病院・連携病院は都市部に偏在しがちで、住んでいる地域によって受けられる医療の質に差が生じる地域間格差も解決すべき課題として挙げられています。
このように個別化医療の実現には技術・制度・倫理・体制の各面での整備が必要です。しかし、これらの課題は技術の進歩、制度の整備、そして社会全体での理解と支援により徐々に解決に向かうことが期待されています。
次の章では、これらの課題を乗り越えた先にある、個別化医療とSDGsとの関係性について考察します。*5)
個別化医療とSDGs

個別化医療とSDGs(持続可能な開発目標)は、「誰一人取り残さない」という誓いのもと、一人ひとりの尊厳と健康を最大化するという点で深く共鳴しています。この先進的な医療は、個人の健康寿命を延ばすだけでなく、医療資源の効率化や技術革新を通じて、より多くの人が質の高い医療にアクセスできる社会基盤の実現に貢献します。
個別化医療の実践が、SDGsのどの目標達成にどのように影響を与えるのか、特に繋がりの深い三つの目標を見ていきましょう。
SDGs目標3:すべての人に健康と福祉を
個別化医療は、この目標の中核概念である「ユニバーサル・ヘルス・カバレッジ(UHC)」(すべての人が支払い可能な費用で適切な医療サービスを受けられる状態)の達成に直結します。
バイオマーカー(生体内の目印)に基づき、効果が期待できる患者さんに最適化された治療法を選択することで、効果のない治療の「空振り」を減らせます。これは患者さんの身体的負担を軽減するだけでなく、高額な薬剤費や入院費といった無駄な医療資源の浪費を防ぎ、医療費の適正化にもつながります。
さらに、ゲノム情報を活用した予防医療は、がんや糖尿病といった非感染性疾患(NCDs)にかかりやすいリスクを事前に予測し、発症前の先制介入を可能にします。これは目標3のターゲット3.4「非感染性疾患による若年死亡率を3分の1減少させる」の達成に具体的に貢献し、人々の健康寿命を延ばします。東北大学の研究プロジェクトでは、個別化医療により医療格差を是正し、健康長寿社会の実現を図る取り組みが進められています。
SDGs目標9:産業と技術革新の基盤をつくろう
個別化医療の発展は、それ自体が最先端の科学技術(イノベーション)の結晶です。
- 次世代シークエンサー(NGS)による超高速ゲノム解析
- AI(人工知能)を用いた膨大な生体情報の解析(バイオインフォマティクス)
- 新たな分子標的薬や核酸医薬の開発
など、その実現には多様な分野の研究開発が必要です。
国立がん研究センターが主導するSCRUM-Japanのような大規模ゲノム解析プロジェクトは、希少な遺伝子変異を持つ患者に新薬を届けるだけでなく、診断技術そのものの革新をもたらしています。これらの研究開発への投資や実践は、ターゲット9.5「研究開発を強化し、イノベーションを促進する」活動そのものであり、強靭な医療・製薬産業の基盤構築に貢献します。
SDGs目標10:人や国の不平等をなくそう
個別化医療は、医療における不平等の解消に貢献する大きな可能性を秘めています。ゲノム解析技術は、これまで診断がつかずに苦しんでいた希少疾患・難病の患者に、正確な診断と治療の道を開く希望となっています。
また、リキッドバイオプシー(血液検査)による遺伝子解析技術の発展により、組織採取が困難な患者でも個別化医療を受けられるようになってきました。
近年では、AIやデジタル技術を活用した遠隔診断システムの整備により、地理的な制約を越えて専門的な医療へのアクセスが可能になりつつあります。こうした取り組みは、SDGs目標10の目指す、「年齢、性別、障害、人種、民族、出自、宗教、あるいは経済的地位その他の状況に関わりなく、全ての人々の能力強化及び社会的、経済的及び政治的な包含を促進する」の実現につながります。
しかしその一方で、この目標達成には重大な課題も存在します。前の章で触れた通り、高額な検査・治療コストや、専門人材・高度医療機関の都市部への偏りが、患者の経済状況や居住地による新たな医療アクセス格差を生み出す危険性をはらんでいます。
技術革新の恩恵をすべての人に公平に行き渡らせるためには、公的保険の適用拡大やELSI(倫理的・法的・社会的課題)を考慮した制度設計が必要です。
個別化医療は、SDGsの理念を医療の現場で具体化する力を持っています。次の章では、これまでの内容を振り返り、個別化医療の未来と私たちの選択についてまとめます。*6)
>>SDGsに関する詳しい記事はこちらから
まとめ

個別化医療は、患者一人ひとりの遺伝情報(ゲノム)や体質に基づき、最適な治療や予防法を提供する医療の新たなパラダイムです。画一的な標準治療から「個」の特性に精密に焦点を当てるこの転換は、
- 治療効果の最大化
- 副作用の軽減
- 医療費の適正化
を現実のものとしつつあります。
2025年現在、世界の個別化医療市場は年平均成長率8.24%で拡大し、2024年の5,729億ドルから2033年には1兆1,683億ドルへと倍増すると予測されています。AIによる診断支援やリキッドバイオプシー(血液検査)技術の進歩がこれを加速させ、日本でも「医療DX令和ビジョン2030」のもと全国医療情報プラットフォームの構築が進むなど、個別化医療は研究段階を超え、本格的な社会実装のフェーズに入っています。
しかし、この革新的な医療の恩恵をすべての人に届けるには、以下のような世界共通の課題が残されています。
- 高額な検査・治療コストがもたらす経済的格差
- 専門人材や高度医療機関の地域的偏り
- 遺伝情報という究極の個人情報を扱うELSI(倫理的・法的・社会的課題)
特に先進国と開発途上国の間で、この高度医療へのアクセス格差が拡大しないよう、国際的な協調と公平な制度設計が重要です。
個別化医療について知識を深めておくことは、将来自身や大切な人が医療の選択を迫られたとき、最善の判断をするための力となります。また、一人ひとりが医療に対する関心を持ち、医療格差の是正や倫理的課題の解決に向けた社会的議論に参加することが、公平で質の高い医療を実現する第一歩となるでしょう。
遺伝子解析の技術が発展し、様々な場面での活用が期待される中、あなたは自分や家族の健康情報をどのように守り、そして活かしていきたいと考えますか。また、すべての人が最適な医療を公平に享受できる未来を築くために、私たちに何ができるでしょうか。
個別化医療の進歩と、一人ひとりの健康と尊厳。その二つが交わるところにある、公平で質の高い医療の実現に向けて、これからも学び、責任ある行動を心がけていきましょう。*7)
<参考・引用文献>
*1)個別化医療とは
中外製薬株式会社『個別化医療とは?』
株式会社日立総合計画研究所『Precision Medicine』
日本医療政策機構『がん個別化医療」の特質を踏まえた医療体制等の整備』(2022年9月)
東北大学病院『個別化医療とは?PERSONALIZED MEDICINE』
日本未来科学館『ゲノムを利用した個別化医療を考える』(2025年8月)
*2)個別化医療とこれまでの医療との違い
国立がん研究センター『がん個別化医療による生存期間の延長を確認』(2024年7月)
国立がん研究センター がん情報サービス『標準治療と診療ガイドライン』
公益社団法人日本乳癌学会『Q7 標準治療とは何ですか』(2023年)
ロシュ・ダイアグノスティックス株式会社『ロシュが支える「個別化医療」で、患者さん一人ひとりに最適な治療を選ぶ』(2022年9月)
日本医療政策機構『層別化医療と個別化医療の比較』
日経メディカル『理想のオーダーメイド治療はこんな形で行われる』(2014年2月)
*3)個別化医療の具体事例
医薬品医療機器総合機構『医薬品の開発・承認審査に関わる個別化医療の現状評価』(2014年3月)
国立がん研究センター SCRUM-Japan『プロジェクトの成果とは』
東北大学『日本人CYP2E1遺伝子多型の網羅的機能解析に成功』(2025年10月)
日本核酸医薬学会『米国で先行する超希少疾病の核酸医薬を用いた個別化医療』
MIT Technology Review『遺伝子編集薬で初の個別化医療、希少疾患の治療先例に』(2025年5月)
*4)個別化医療のメリット
中外製薬株式会社『個別化医療がもたらすメリットとは?』
QLife『がん個別化医療による生存期間の延長を確認』(2024年8月)
ガーダントヘルス・ジャパン株式会社『大規模研究GOZILA Studyにおいて「Guardant360® CDx がん遺伝子パネル検査」の有用性が示される』(2024年9月)
日本製薬工業協会『個別化医療実現に向けた製薬企業の動向』(2011年)
東北大学『CYP2E1遺伝子多型の網羅的機能解析に成功〜薬物代謝の個人差解明と個別化医療への応用に期待〜
(2025年10月)
*5)個別化医療のデメリット・課題
中外製薬株式会社『個別化医療の課題と展望とは?』
日本医療政策機構『がん個別化医療」の特質を踏まえた医療体制等の整備』(2022年9月)
内閣官房健康・医療戦略推進本部『ゲノム医療、個別化医療の実現に向けた研究開発における課題』(2023年3月)
厚生労働省『先進医療の内容(概要)』(2018年3月)
個人情報保護委員会『医療・医学系研究における個人情報の保護と利活用』(2024年4月)
*6)個別化医療とSDGs
国際協力機構『ユニバーサル・ヘルス・カバレッジ(UHC)』(2023年6月)
全日本科学技術協会『人に優しい個別化医療の開発・普及による次世代医療構築と医療格差是正(個別化医療)』(2021年3月)
国連広報センター『ユニバーサル・ヘルス・カバレッジ(UHC) すべての人に健康を』(2017年11月)
*7)まとめ
厚生労働省『「医療DX令和ビジョン2030」厚生労働省推進チーム』
日本製薬工業協会『製薬医学2030年の展望 −医療の多様化・個別化を進める』(2023年2月)
Siemens Healthineers『We pioneer breakthroughs in healthcare. For everyone. Everywhere.Sustainably.』(2025年5月)
この記事を書いた人
松本 淳和 ライター
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。