生命の設計図である遺伝子を精密に書き換えるCRISPR-Cas9技術は、医療・農業・環境問題の解決において、従来不可能だったアプローチを可能にしました。世界初のゲノム編集治療薬承認から高機能作物の開発まで、この技術の恩恵は急速に社会に広がっています。
一方で、倫理的課題や安全性への懸念も指摘され、議論が続いているのも現状です。CRISPR-Cas9の基礎的な原理や利用例、課題をわかりやすく解説します。
目次
CRISPR-Cas9とは
【サーマス・サーモフィラス由来CRISPR関連タンパク質の結晶構造】
CRISPR-Cas9(クリスパー・キャスナイン)とは、生命の設計図であるゲノムの中から狙った遺伝子を、従来とは比較にならないほど簡単、安価、そして正確に編集できる革新的な技術です。その圧倒的な使いやすさから「第3世代のゲノム編集ツール」と呼ばれ、生命科学のあり方を根本から変える可能性を秘めています。
まずは、CRISPR-Cas9を構成する主な要素と、この技術が生まれるまでの歴史を確認しておきましょう。
ガイドRNA:遺伝子を「探し出す」高精度なナビゲーター
CRISPR-Cas9システムの根幹をなすのが、ゲノムという広大な情報の中から、目的の遺伝子配列(住所)を正確に探し出す「ナビゲーション機能」です。この重要な役割を担っているのが「ガイドRNA」※と呼ばれる分子です。
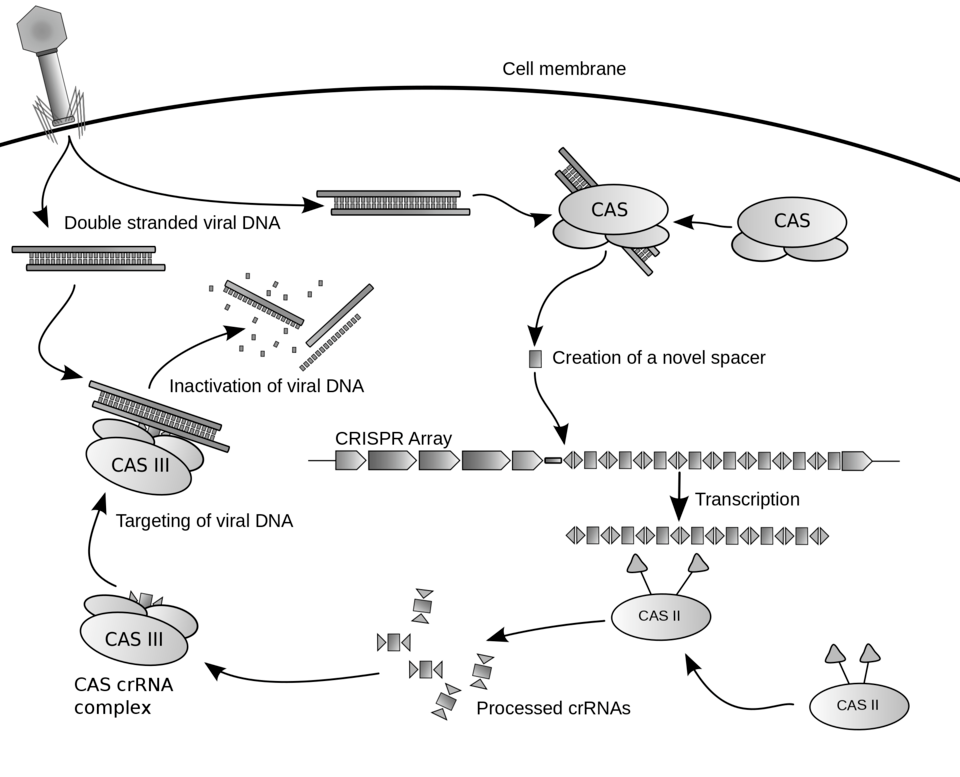
この技術は、もともと細菌がウイルスから身を守るための免疫システム(CRISPR)から着想を得ています。ゲノム編集では、この仕組みを応用し、編集したい標的遺伝子の配列情報をもとに、人工的に「ガイドRNA」を設計します。
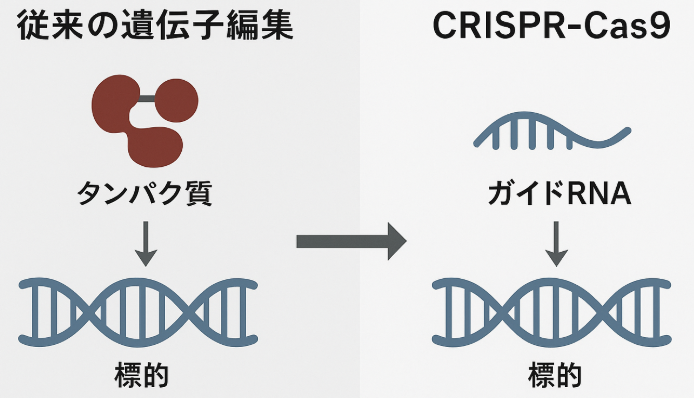
このガイドRNAを細胞内に導入すると、まるでGPSのように目的の遺伝子を探し出し、そこにしっかりと結合します。従来の技術では、標的ごとに複雑な「タンパク質」を設計する必要がありましたが、CRISPR-Cas9では安価で作成が容易な「RNA」で標的を探せるため、より使いやすい画期的なツールとなったのです。
ゲノム
ゲノムとは、ある生物が持つ遺伝情報の全てを指す総称です。生命の設計図が書かれた「一冊の本」とすると、設計図の文字情報がDNA、個々の意味を持つ文章が遺伝子にあたります。
ヒトゲノムには約30億文字(塩基対)の情報が含まれると言われています。これらは以下のように整理できます。
- ゲノム:生物が持つ全遺伝情報の設計図
- DNA:デオキシリボ核酸と呼ばれる二重らせん構造の高分子
- 遺伝子:DNA上に存在するタンパク質やRNAの設計情報を持つ領域
- 塩基:A・T・G・Cの4種がペアを形成し情報を符号化
従来技術より簡単で安価な「ガイドRNA」
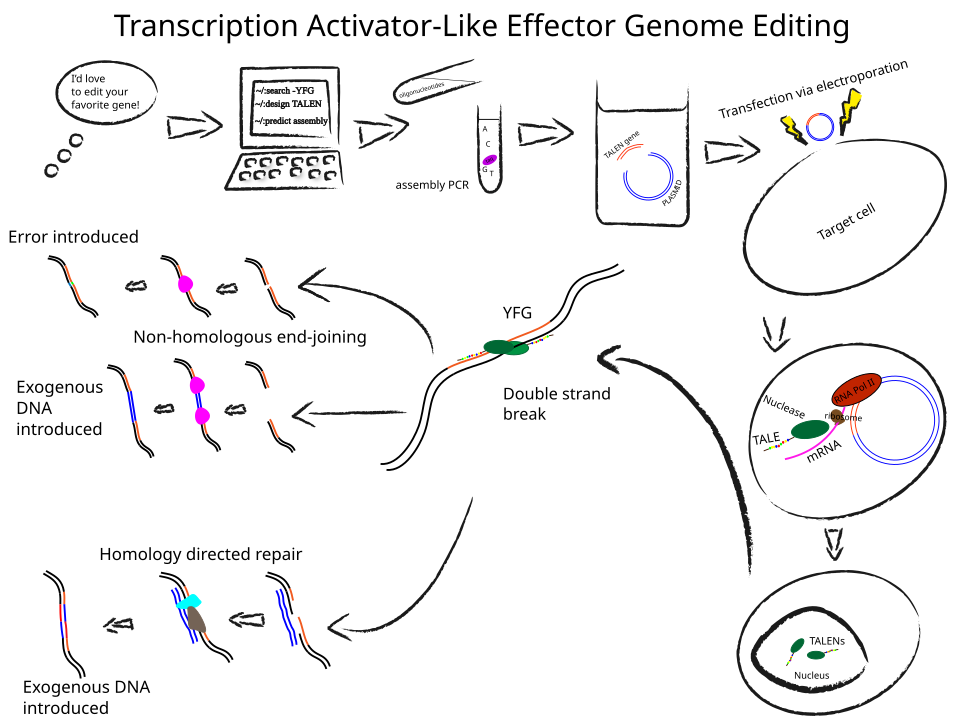
従来のZFNやTALENでは、標的DNAごとに専用のタンパク質を設計・構築する必要がありました。ZFNは3~6個のジンクフィンガー※を組み合わせ、TALENでは15~20個のモジュール(合計500~680アミノ酸)を連結した巨大なタンパク質を作る必要があり、部品間の干渉も考慮するため開発は複雑で高コストでした。
【TALENゲノム編集のワークフローの例】
これに対し、CRISPR-Cas9で用いるガイドRNAは、ワトソン・クリック塩基対結合※(A–T、G–C)という自然の法則を利用し、標的DNAに相補的な約20塩基の配列を設計するだけで済みます。化学合成技術により数日で製造でき、費用もおよそ17,000円程度と比較的安価です。
さらにCas9タンパク質は共通部品として使い回せるため、標的が変わってもガイドRNAを差し替えるだけで対応可能です。
この仕組みにより、ゲノム編集は数か月を要する専門技術から、数日で実現できる汎用技術へと大きく進化しました。
【ゲノム編集】
Cas9タンパク質:DNAを「切断する」分子のハサミ
ナビゲーター役のガイドRNAとペアを組んで働くのが、「Cas9(キャスナイン)」というタンパク質です。その役割は「分子レベルの非常に精密なハサミ」と表現できます。
Cas9タンパク質は、ガイドRNAに導かれることで初めてその能力を発揮します。ガイドRNAが標的のDNAに結合すると、そこに連れてこられたCas9が、標的のDNAを鋭く二本鎖切断します。
このシステムの優れた点は、ハサミ役であるCas9は常に同じものを使い続けられるという高い汎用性にあります。研究者が標的に合わせて変えるのはガイドRNAだけで済むため、研究開発のスピードとコストが劇的に改善されました。
このようにCRISPR-Cas9とは、
- 目的の遺伝子を「探し出す」ガイドRNA
- DNAを「切断する」Cas9タンパク質
という、2つのシンプルな組み合わせから成る非常に効率的なツールです。
では、この「切断」の後、どのようにして遺伝子の編集が完了するのでしょうか。次の章では、その核心であるCRISPR-Cas9の原理を、さらに詳しく見ていきましょう。*1)
CRISPR-Cas9の原理
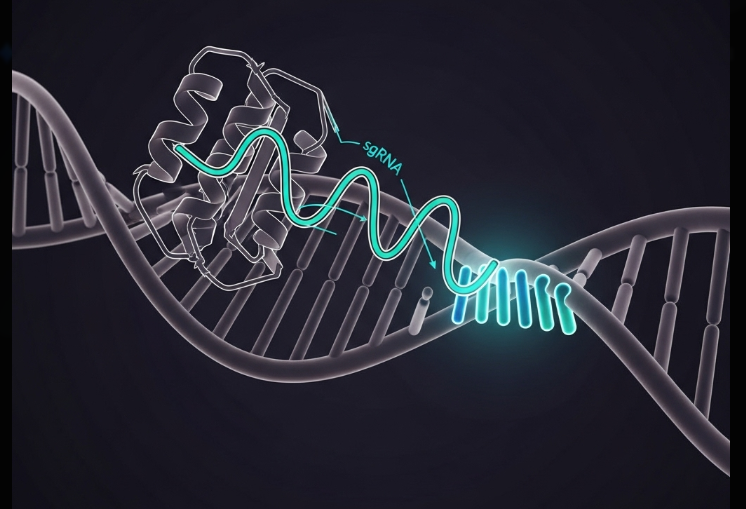
CRISPR-Cas9は、具体的にどのような手順で、生命の設計図であるDNAを正確に書き換えるのでしょうか。その核心は、「探索」「認識」「切断」「修復」という、生命が持つ仕組みを巧みに利用した一連の流れにあります。
ここでは、CRISPR-Cas9が遺伝子を編集する核心的なプロセスを、段階を追って見ていきましょう。
ステップ①:標的遺伝子の探索と結合
ゲノム編集の最初のステップは、膨大な遺伝情報の中から、目的の遺伝子だけを正確に見つけ出すことです。この精密な探索は、研究者が編集したい場所に合わせて自由に設計できるガイドRNAが主役となります。
現在、研究で標準的に使われているのは、天然の仕組みをさらにシンプルに改良したsgRNA(シングルガイドRNA)※です。このsgRNAは、ハサミ役のCas9タンパク質と結合した状態で細胞内に入り、DNA上をスキャンします。
そして、sgRNAが持つ塩基配列と完全に一致する配列をDNA上で見つけると、そこに結合します。
ステップ②:二重チェックによる認識とDNA二本鎖の切断
Cas9は、非常に巧妙な二重チェック(ダブルチェック)の仕組みによって、極めて正確に標的を定めます。まずCas9は、PAM(パム)配列※と呼ばれる短い目印となる塩基配列をゲノム上で探し出します。
これが第一のチェックです。Cas9は、このPAMという目印に結合して初めて、第二のチェックに移ります。
第二のチェックは、隣接するDNA配列が、連れているガイドRNAの配列と完全に一致するかどうかの検証です。この二段階の認証が通った場合にのみ、Cas9は活性化し、ハサミとしての機能を発揮して、標的のDNA二本鎖を狙い通りに切断します。
この二重チェック機構が、ゲノム編集の精度の高さを支える重要な鍵となっています。
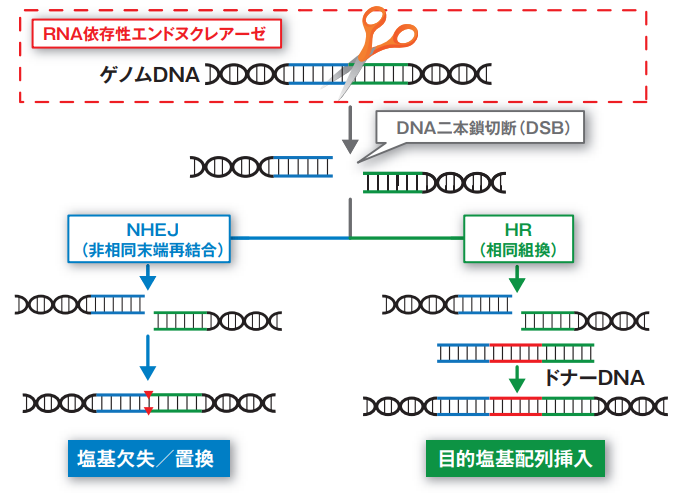
ステップ③:細胞自身の修復機能を利用した遺伝子編集
DNAが切断されると、細胞は元々備わっているDNA修復システムを起動させ、傷を治そうとします。ゲノム編集は、この細胞自身の修復プロセスを巧みに利用することで完了します。
この修復ルートは主に2種類あります。
- 非相同末端結合(NHEJ)
いわば「応急処置」的な修復方法です。切れたDNAの末端同士を急いでつなぎ合わせるため、修復ミスが起こりやすく、数個の塩基が欠けたり挿入されたりします。この小さなエラーを意図的に起こすことで、遺伝子の機能を「壊す(ノックアウト)」ことができます。 - 相同組換え修復(HDR)
正常なDNAを「お手本(鋳型)」にして、切断箇所を正確に修復する精巧な仕組みです。この性質を利用し、あらかじめお手本となるDNAを細胞内に導入しておくことで、異常な遺伝子を正常なものに「書き換える(ノックイン)」ことや、新たな遺伝子を「挿入する」ことが可能になります。ただし、このHDRによる修復はNHEJに比べて効率が低く、特に活発に増殖している細胞で働きやすいという特徴があります。
【CRISPRシステムのメカニズム】
このようにCRISPR-Cas9の原理とは、外部から持ち込むツールと、生命が本来持つ能力を組み合わせた、非常に巧妙な技術です。その仕組みのシンプルさも注目すべき点で、研究者が外部から導入するのは基本的に「ガイドRNA」と「Cas9タンパク質」だけです。
このシンプルなツールが引き金となり、細胞自身の精巧な修復システムを利用して、生命の設計図を精密に編集することができるのです。*2)
CRISPR-Cas9の歴史

今日、生命科学に革命をもたらしたCRISPR-Cas9ですが、この技術はある日突然生まれたわけではありません。その背景には、一人の日本人研究者による偶然の発見から始まり、世界中の科学者たちが少しずつ謎を解き明かしていった、約25年にわたる壮大な科学の物語があります。
この技術がどのように生まれ、進化してきたのか、重要な節目を時系列で辿ってみましょう。
ゲノム編集の夜明け:先行技術の登場
ゲノムを「編集する」という概念は、CRISPR-Cas9以前から存在しました。1990年代から2000年代にかけて開発されたZFNやTALENといった技術は、特定のDNAを狙って切断することを可能にし、遺伝子研究を大きく前進させました。
しかし、これらは標的ごとに複雑なタンパク質を設計する必要があり、非常に手間とコストがかかるという課題がありました。科学者たちは、より簡便で安価な新しいツールを求めていたのです。
1987年:日本人研究者による「奇妙な配列」の発見
【石野 良純博士】
CRISPR-Cas9は、1987年に大阪大学の石野良純博士(現・九州大学教授)による偶然の発見から始まります。石野博士は大腸菌の遺伝子解析中、同じ塩基配列が規則正しく繰り返される不思議な領域を発見しました。これが後にCRISPR※と呼ばれる配列です。
当時はその機能が全くの謎であり、論文にも「役割は分からない」と記すに留まりました。この小さな発見が、後の生命科学を根底から変える技術の出発点になるとは、誰も予想できませんでした。
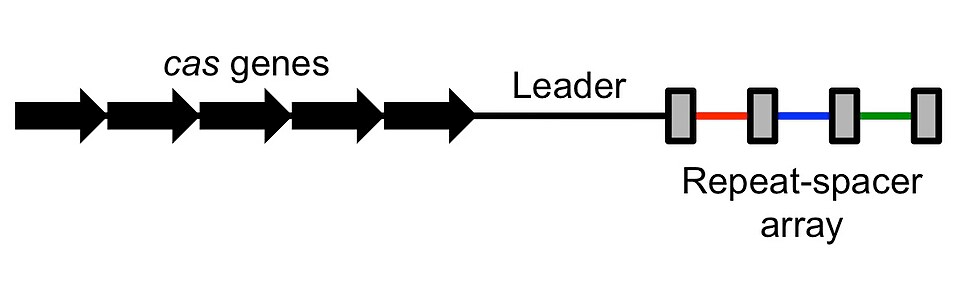
【CRISPR座位の概略図】
※グレーの四角がリピート、カラーの棒がスペーサーを示している。
2000年代:機能解明への道のり
石野博士の発見から約15年後、研究は本格化します。スペインのフランシスコ・モヒカ博士らが、この配列が多くの細菌に共通して存在することを突き止め、CRISPRと命名しました。
決定的な進展は2007年、ロドルフ・バラングー博士らのチームによる研究です。彼らはCRISPRが細菌の「獲得免疫」(一度侵入したウイルスの情報を記憶し、二度目の侵入時に撃退する仕組み)として機能することを実験的に証明しました。これにより、長年の謎だったCRISPRの役割が遂に解明され、後の技術開発への道が開かれました。
2012年〜2020年:ゲノム編集ツールとしての完成とノーベル賞
転機は2012年に訪れます。フランスのエマニュエル・シャルパンティエ博士とアメリカのジェニファー・ダウドナ博士が、この細菌の免疫システムを応用し、任意のDNA配列を自在に切断できる汎用的なゲノム編集ツールとして完成させました。
この画期的な成果により、CRISPR-Cas9は瞬く間に世界中の研究室に普及したのです。両博士は2020年にノーベル化学賞を受賞し、ノーベル委員会は「遺伝子操作はもはや実験的な制約ではない」とその絶大な影響を評価しました。
【エマニュエル・シャルパンティエ博士(左)とジェニファー・ダウドナ博士(右)】
CRISPR-Cas9の歴史は、一人の日本人研究者による基礎研究での偶然の発見が、世界中の科学者による知の継承を経て、人類に多大な貢献をもたらす革新技術へと昇華した、現代科学の象徴的な成功例です。*3)
CRISPR-Cas9は何に活用されるのか
CRISPR-Cas9は、わずか10年余りで生命科学の研究現場を一変させた革新的技術です。その可能性は学術研究に留まらず、医療、農業、基礎研究、産業応用にまで広がり、私たちの生活や社会に具体的な変化をもたらしつつあります。
ここでは、特に注目される3つの分野における活用例を見ていきましょう。
①医療分野での応用
CRISPR-Cas9は、遺伝性疾患やがんなど従来治療が困難な病気に対する新しい治療法として期待されています。
CAR-T細胞療法の改良
患者自身のT細胞を改変し、がん細胞への攻撃力を高める治療法です。CRISPR-Cas9でPD-1やCTLA-4といった阻害性レセプターを除去することで、T細胞の疲弊を防ぎ、より効果的な治療が可能になります。
遺伝性疾患の根本治療
家族性トランスサイレチンアミロイドーシスなどで、病気の原因遺伝子を肝細胞で直接ノックアウトする臨床試験が進行中です。副作用を抑えつつ症状の改善が確認されています。
疼痛管理
動物実験レベルで、CRISPRによる特定遺伝子の抑制により慢性疼痛を緩和する研究成果も報告されています。
②農業・食品分野での応用
作物や家畜の改良においても、CRISPR-Cas9は従来の品種改良を大幅に効率化しています。
機能性作物の開発
筑波大学の研究チームは、GABAを通常の4〜5倍含む高GABAトマトの作出に成功しました。このトマトは、血圧予防やストレス緩和に期待される栄養価向上と収量維持を両立し、注目されています。
外来遺伝子を用いない「編集」
遺伝子組み換え技術とは異なり、従来の品種改良と同等の安全性評価で扱える点も利点です。
【トマトは重要作物→世界的に研究が推進】
③基礎研究・創薬分野での応用
CRISPR-Cas9は、疾患モデルの作製や創薬研究の加速に大きく貢献しています。
疾患モデル動物の作製
従来数年を要したノックアウトマウス※作製が、受精卵への直接編集で約1か月に短縮可能になりました。
薬剤耐性モデル細胞の開発
CRISPR-Cas9により白血病細胞株に薬剤耐性遺伝子変異を導入することで、従来困難だった耐性機構の詳細解析が可能になりました。この技術により新規治療薬のスクリーニングが効率化され、薬剤耐性克服のための創薬研究が大幅に加速されています。
このように、CRISPR-Cas9は、医療、農業、基礎研究といった多様な分野で具体的成果を生み出しており、単なる研究ツールを超えて社会的価値を持つ技術です。安全性と効率性が確立されるにつれ、今後さらに多くの応用分野での活用が期待されています。*4)
CRISPR-Cas9の課題

革新的な可能性を秘めるCRISPR-Cas9ですが、生命の設計図に直接手を加えることの難しさ、そしてその行為に伴う責任は、技術の進歩と同時に私たちが真剣に向き合わなければならない重い課題です。この先進技術が直面している主要な課題を、技術的・倫理的・社会的な観点から詳しく見ていきましょう。
技術的な安全性:オフターゲットを超えた課題
CRISPR-Cas9の実用化において最も懸念されるのが、狙った遺伝子以外を誤って編集してしまうオフターゲット効果です。しかし、研究が進むにつれて、それ以外にも乗り越えるべき技術的なハードルが見えてきました。
予期せぬタンパク質の生成
理化学研究所の報告によると、ゲノム編集で遺伝子の機能をオフにした(フレームシフト変異させた)つもりが、細胞内で予期せぬ機能を持つ別のタンパク質が作られてしまう現象が発見されました。これは、遺伝子配列の確認だけでは不十分で、実際にどのようなタンパク質が作られるかまで検証する必要があることを示しています。
長期的な安全性の評価
遺伝子治療を行った後、数年、数十年という長いスパンで副作用が出ないかを評価することも極めて重要です。従来の予測ツールでは見つけにくい長期的なリスクを評価するため、ドイツの研究チームが新しい評価法(LATEアッセイ)を開発するなど、安全性を担保するための地道な研究が続けられています。
生命倫理の壁:「ゲノム編集ベビー」が問いかけたこと
CRISPR-Cas9技術は、生命そのものに手を加えることの是非を問う、深刻な倫理的課題を私たちに突きつけています。
その議論を決定的にしたのが、2018年に中国の賀建奎(が・けんけい)元副教授が、HIV感染を防ぐ目的でゲノム編集した双子を誕生させたと発表した「ゲノム編集ベビー」事件です。
この行為は、子孫にまで影響が及ぶ「生殖細胞」への応用であり、世界中から科学的・倫理的に厳しい非難を浴びました。この事件をきっかけに、各国で規制強化の動きが加速しました。
日本では現在、国の指針で生殖細胞への臨床応用は禁止されていますが、より厳しい法規制の必要性が議論されています。日本学術会議も「人の尊厳」を守る観点から法制化を提言しており、WHO(世界保健機関)主導で国際的なルール作りも進められています。
社会的な課題:格差とルール作り
CRISPR-Cas9が広く普及した未来には、新たな社会問題が生まれる可能性も指摘されています。
遺伝的格差の懸念
もしゲノム編集による治療法が高額になれば、経済的に裕福な層だけがその恩恵を受け、遺伝的な能力や健康の格差が社会に生まれる「遺伝的格差」につながる恐れがあります。この格差は次世代に受け継がれるため、社会の分断を深刻化させる危険性をはらんでいます。
品質管理と人材育成
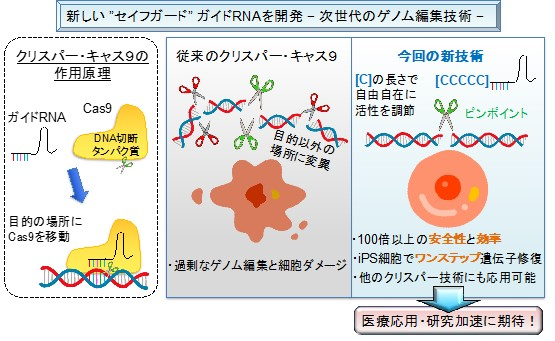
技術が普及する一方で、実験の品質をいかに担保するかという課題もあります。九州大学の研究チームが開発した、CRISPR-Cas9の活性を自在に調節して安全性を100倍以上向上させる新技術のように、技術的な改良は日々進んでいますが、それを正しく扱える専門人材の育成や、標準化されたルールの整備が追いついていないのが現状です。
【ゲノム編集の効率や安全性を100倍以上高める新技術】
CRISPR-Cas9が抱えるこれらの課題は、技術的改良はもちろん、国際的な規制、社会全体での倫理議論、そして誰もが公平に恩恵を受けられる仕組み作りを通じて、一つひとつ丁寧に対処していく必要があります。この革新的な技術を真に人類の幸福に繋げるためには、科学の進歩とともに、それを適正に使いこなす社会の成熟が求められているのです。*5)
CRISPR-Cas9とSDGs

生命科学の力で課題解決を目指すCRISPR-Cas9と、持続可能な社会を目指すSDGsは、「より良い未来を創る」という共通の目的を持っています。この革新的なゲノム編集技術は、特に食料、健康、環境問題において、目標達成を加速させる強力な科学的ツールとして期待されています。
SDGs目標2:飢餓をゼロに
気候変動や人口増加が進む中、安定的で栄養価の高い食料供給はSDGs達成の根幹ですCRISPR-Cas9は、厳しい環境でも育ち、栄養価の高い作物を短期間で開発することを可能にします。
- 耐環境性作物の開発: 横浜市立大学の研究チームは、遺伝子の働きを精密に調整し、干ばつや塩害に強い植物の開発に成功。これまで作物が育ちにくかった土地での食料生産に道を開いています。
- 栄養価の向上: 農研機構は、発展途上国で問題となるビタミンA欠乏症の解決に向け、体内でビタミンAに変わるβカロテンを豊富に含むイネを開発。食料の「質」の改善にも貢献しています。
SDGs目標3:すべての人に健康と福祉を
これまで治療が困難だった遺伝性疾患や難病の克服は、この目標の核心ですCRISPR-Cas9は、病気の原因遺伝子を直接修復する根本治療を現実のものとしました。
- 世界初のゲノム編集治療薬: 遺伝性血液疾患の治療薬「Casgevy」が世界で初めて承認され、一度の治療で生涯にわたるQOL(生活の質)の劇的な改善が期待されています。
- 予防医学への貢献: 「高GABAトマト」のような機能性食品は、血圧上昇抑制などの効果が期待され、日々の食事を通じた病気の予防という観点から健康増進に貢献します。
SDGs目標14:海の豊かさを守ろう
海洋資源の保全と持続可能な水産業の実現にも、CRISPR-Cas9は貢献します。養殖業の効率化は、天然資源への依存を減らす上で極めて重要です。
- 効率的な養殖業の実現: 病気に強く、少ない餌で早く育つ魚の品種改良が進められています。実際に、成長速度が約2倍になったトラフグや、筋肉量が約1.6倍に増えた真鯛が開発され、より少ない環境負荷で水産物を生産する未来が見えています。
- 海洋生態系の保全: 将来的には、海水温の上昇に耐性を持つサンゴを開発するなど、気候変動から海の豊かさを守る研究も期待されています。
CRISPR-Cas9は、食料安全保障から健康増進、環境保全まで多岐にわたるSDGs目標の達成を加速させる革新的な科学的基盤技術です。その応用と倫理的配慮を両立させることで、持続可能な社会の実現に大きく貢献すると期待されます。*6)
>>SDGsに関する詳しい記事はこちらから
まとめ
【CRISPR/Cas9のイメージ】
CRISPR-Cas9は、DNAという生命の設計図を精密に編集できる第3世代のゲノム編集技術であり、医療・農業・基礎研究に大きな変革をもたらしました。その最大の特徴は、安価で扱いやすく、しかも高精度で遺伝子改変が可能になったことで、世界中の研究室で一気に普及した点にあります。
2023年には世界初のゲノム編集治療薬「Casgevy」※が英国で承認され、翌年には米国でも認可されました。これは長年理論上に留まっていた可能性が、現実の治療として患者に届いた歴史的な出来事です。
さらに近年はAIによる設計支援で精度が大幅に高まり、オフターゲット効果を最小限に抑える技術革新も進んでいます。これにより、安全性と実用性の両面で大きな前進が確認されています。
一方で、高額な治療費による先進国での格差や、途上国におけるアクセス不足は深刻な課題です。しかし、深くグローバルな視点で見ると、CRISPR-Cas9は地域や経済状況にかかわらず人々の生活を改善できる可能性を秘めています。
例えば、
- 干ばつ地帯での耐性作物による食料安定
- 人口密集地における効率的な水産業
- 難病患者に対する根本治療
など、各地域の課題に応じた恩恵を届けることができます。
私たちが、この技術を理解することは、科学と社会の関係を知り、倫理的な判断力を磨くためにも重要です。個人としては正確な情報に触れ、利点とリスクを冷静に見極めながら、「誰が恩恵を受け、誰が取り残されるのか」「科学の進歩をどう人類の幸福に結びつけるのか」と問い続ける姿勢が求められます。
一人ひとりが科学リテラシーを高め、対話に積極的に関わることで、CRISPR-Cas9は持続可能で公平な未来を実現する力となります。この革新を人類全体の繁栄へと導けるかどうかは、私たち自身の意識と選択にかかっているのです。*7)
<参考・引用文献>
*1)CRISPR-Cas9とは
WIKIMEDIA COMMONS『PDB 1wj9 EBI』
WIKIMEDIA COMMONS『TALEN copy』
タカラバイオ『ゲノム編集製品ガイド』
内閣府『ゲノム編集技術等について』
文部科学省『革新的な細胞操作技術の開発と細胞制御機構の解明』(2023年3月)
Spaceship Earth『ゲノム編集・遺伝子編集とは?メリット・デメリット、活用事例も』(2025年7月)
COSMO BIO『特集:CRISPR-Cas9 とは』
COSMO BIO『CRISPR-Cas9 基本の「き」』
三菱電機『【ノーベル賞解説】「クリスパー・キャス9」って何?新型コロナにも有効?』
Wikipedia『CRISPR』
Wikipedia『Cas9』
東京大学『【研究発表】光で意のままにゲノムを編集する技術を開発』(2024年5月)
京都大学『高効率で自在なゲノム改変技術の開発に成功』(2018年2月)
東邦大学『CRISPR/Cas9を用いたゲノム編集』
九州大学『ゲノム編集の効率や安全性を100倍以上高める新技術を開発』(2023年4月)
日本生化学会『CRISPR-Cas9の構造と機能』(2015年12月)
日本学術会議『我が国の医学・医療領域におけるゲノム編集技術のあり方』(2017年9月)
日本生物物理学会『核酸構造「核酸構造と計算化学」』
日本再生医療学会『ゲノム編集技術を用いた遺伝子治療用製品等の品質・安全性等の考慮事項に関する報告書』(2020年2月)
河合 康洋『ゲノム編集技術の現状と可能性』(2016年)
FASMAC『人工遺伝子合成』
*2)CRISPR-Cas9の原理
科学技術振興機構『CRISPR-Cas9がDNAを切断する瞬間の撮影に成功』(2017年11月)
日本RNA学会『CRISPR そしてゲノム編集へ…』(2020年11月)
COSMO BIO『CRISPR-Cas9 – gRNAデザイン』
COSMO BIO『CRISPR-Cas9 sgRNAライブラリーを利用したゲノムワイド機能解析アプローチ』
大阪大学『DNA 二本鎖切断修復方法の選択メカニズムの解明 (Elucidation of the mechanism of pathway choice for the repair of DNA double strand break)』(2023年3月)
遺伝性疾患プラス『ゲノム編集、そしてCRISPR-Cas9(クリスパー・キャス・ナイン)とは?』(2022年11月)
黒沢 綾,足立 隆『ヒト細胞におけるDNA 二本鎖切断の修復』(2014年5月)
新海 暁男『CRISPR-Casシステムの構造と機能』(2014年7月)
タカラバイオ『ゲノム編集実験ハンドブック』
*3)CRISPR-Cas9の歴史
京都高度技術研究所『これまでの研究を振り返って ~イノベーションに挑戦するために必要なこと~九州大学大学院 農学研究院 教授 石野 良純 氏』
WIKIMEDIA COMMONS『SimpleCRISPR』
在日フランス大使館『フランス人研究者エマニュエル・シャルパンティエ博士が日本国際賞を受賞』
科学技術振興機構『RNA誘導型ヌクレアーゼ、その活性な断片とバリアント、ならびに利用法』
公研『奇妙な繰り返し配列クリスパーの謎【石野良純】』(2021年6月)
東京新聞『「あのとき調べれば…」ノーベル化学賞のゲノム編集「第一発見者」の日本人研究者が漏らした言葉』(2020年10月)
日本RNA学会『CRISPR発見の頃から遺伝子工学の発展を顧みて』(2020年11月)
日本RNA学会『CRISPR そしてゲノム編集へ…』(2020年11月)
官学連携ジャーナル『遺伝子操作「ゲノム編集」のルーツ、クリスパー』(2019年)
Proteintech『CRISPR-Cas9、TALEN、ZFN―遺伝子編集における競争』
石井 哲也『ゲノム編集技術と克服すべき重要課題』(2014年)
在日フランス大使館『2020年ノーベル化学賞にフランス人研究者エマニュエル・シャルパンティエ氏』(2021年6月)
COSMO BIO『CRISPRとTALENの利点と欠点を解説』
山本 卓『ゲノム編集の歴史と基礎』
京都大学『CRISPRとは』
九州大学『農学研究院 石野 良純教授が日本遺伝学会木原賞を受賞
新井 博之『CRISPR -原核生物の免疫システム-』(2009年3月)
Wikipedia『フランシスコ・モヒカ』
Wikipedia『エマニュエル・シャルパンティエ』
Science Portal『今年のノーベル賞【後編】化学賞の欧米女性2氏 プエルトリコで運命的な出会い、共同研究へ』(2020年10月)
Springer Nature『ノーベル化学賞はCRISPR遺伝子編集のパイオニアに』
*4)CRISPR-Cas9は何に活用されるのか
農林水産省『GABA高蓄積トマトの開発と今後の展望』(2020年12月)
文部科学省『バイオバンク動向(主にアジア)、ゲノム関連研究/ゲノム創薬の潮流』(2024年12月)
東京農工業大学『悪性脳腫瘍や遺伝性貧血の発症メカニズムを解明』(2016年9月)
山梨大学『CRISPR/Cas9 によるゲノム編集技術を用いた白血病細胞への分子標的療法剤に対する耐性遺伝子変異の導入―新規治療薬を開発するためのモデル細胞系の樹立方法の確立-』(2018年7月)
VectorBuilder『CRISPRによる臨床CAR-T治療効率の向上』(2023年10月)
Springer Nature『CRISPRを利用した遺伝子治療でマウスの疼痛を緩和』(2021年3月)
筑波大学『ー健康促進トマトとして期待ーゲノム編集技術を利用してγアミノ酪酸(GABA)高含有トマトを作出』(2017年8月)
農研機構『こぼれ話10》ゲノム編集で健康によいトマトが誕生』(2020年8月)
日本医療研究開発帰庫『ノックアウトマウスを短期間で作製する技術の開発―CRISPR/Casゲノム編集を応用した疾患モデルマウスの短期間作製法―』(2017年8月)
小林 良祐,堀居 拓郎,畑田 出穂『実験動物(マウス)におけるゲノム編集:疾患モデルマウス作製の実際』(2022年)
旭化成『ゲノム編集ベビーで標的とされた遺伝子』(2019年1月)
BBC『「世界初のゲノム編集赤ちゃん」の正当性主張 中国科学者』(2018年11月)
日本経済新聞『中国で「ゲノム編集女児」誕生か 大学側は「倫理違反」』(2018年11月)
JAXA『世界初、遺伝子ノックアウトマウス(特定遺伝子を欠失したマウス)の全数生存帰還に成功~「きぼう」での第3回マウス長期飼育ミッションが終了しました~』(2018年5月)
Wikipedia『ノックアウトマウス』
*5)CRISPR-Cas9の課題
厚生労働省『ゲノム編集技術の概要と問題点』(2017年4月)
厚生労働省『ゲノム編集技術を用いたヒト受精胚等について』(2024年9月)
京都大学『CRISPR-Cas9がヒト細胞内のRNAで阻害されてしまう現象を発見し、iPS細胞での効率的な相同組み換えゲノム編集技術を実現』(2021年3月)
京都大学『昆虫ゲノム編集のあたらしい形―成虫注射で「難敵」撃破―』(2022年5月)
九州大学『ゲノム編集の効率や安全性を 100 倍以上高める新技術を開発』(2023年4月)
理化学研究所『ゲノム編集の落とし穴-“セントラルドグマ”が書き直される可能性も-』(2016年12月)
日本学術会議『提言「ゲノム編集技術のヒト胚等への臨床応用に対する法規制のあり方について」のポイント』
日本学術会議『ゲノム編集技術のヒト胚等への臨床応用に対する法規制のあり方について 』(2020年3月)
VectorBuilder『CRISPRはこちら : 送達方法の選び方 キーワード: CRISPR送達, プラスミド, ウイルス, mRNA, RNP』
COSMO BIO『CRISPR-Cas オフターゲット作用をコントロールする』
Reuters『アングル:「ゲノム編集した双子」誕生か、中国で非難の嵐』(2018年11月)
柏倉 裕志,大森 司『血友病に対する遺伝子治療・ゲノム編集治療の進歩』(2020年)
*6)CRISPR-Cas9とSDGs
国際農研『787. ゲノム編集でリン欠乏条件での収量性が向上したイネを作出』(2023年5月)
農研機構『ゲノム編集を用いたイネカルスへのβカロテン蓄積』(2019年)
日本学術会議『気候変動に対応するゲノム基盤技術に基づく次世代ゲノム育種展開』
広島大学『【研究成果】イネなどの野生種の遺伝子に環境ストレス耐性のヒント!〜新品種の開発やゲノム編集への活用に期待〜』
国立医薬品食品衛生研究所『遺伝子組換え食品・ゲノム編集食品』
*7)まとめ
WIKIMEDIA COMONS『NHGRI-97218』
薬事日報『遺伝子治療とは?2025年の最新動向と今後の展望』(2025年8月)
遺伝性疾患プラス『【2025最新版】遺伝子治療はどこまで来たか?専門家が語る現状・課題・展望』(2025年7月)
基礎生物学研究所『アブラムシに最適化したゲノム編集法により越冬卵を守る遺伝子の働きを解明』(2025年8月)
BBC『Casgevy: UK approves gene-editing drug for sickle cell』(2023年11月)
BBC『’I feel lucky to get remarkable gene therapy’』(2025年7月)
この記事を書いた人
松本 淳和 ライター
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。