遺伝子治療は医学史上最大の革命といえる技術でありながら、同時に人類が直面する最も複雑な倫理的課題でもあります。
本記事では、遺伝子治療のメリット・デメリット、安全性や格差の問題、そして「誰一人取り残さない」医療を実現するための課題まで、この先端技術が社会に与える影響をわかりやすく解説します。
目次
遺伝子治療とは
【遺伝子治療】
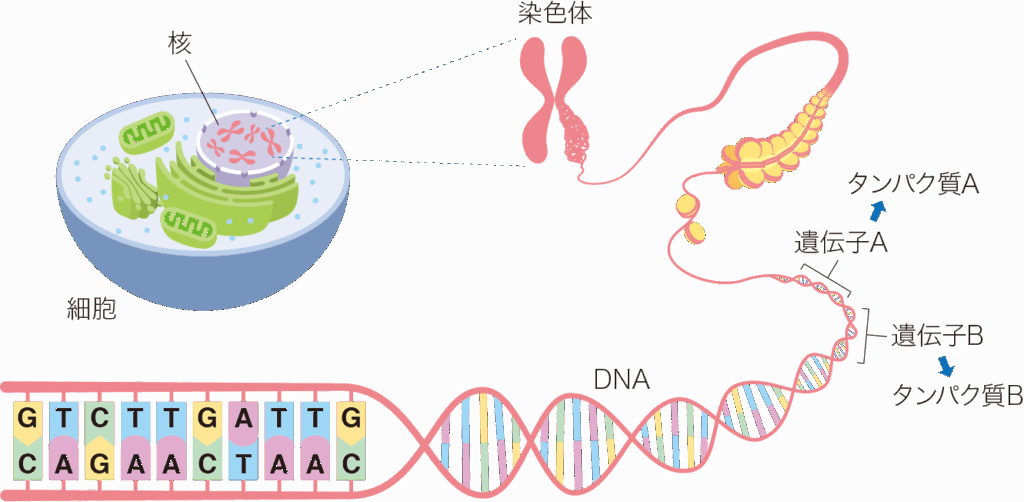
遺伝子治療とは、遺伝子の異常や欠損を修復し、病気の根本的な治療や機能の回復を目指す先進的な医療のことです。従来の薬や手術が「症状を抑える」ことを目的とするのに対し、遺伝子治療は「病気の原因となる遺伝子そのもの」に介入する点が最大の特徴です。
生命の設計図そのものに働きかけられるようになったことで、従来は治療が難しかった難病やがんへの新しい道が開かれています。
この分野は一見すると高度で難解に感じられますが、実際には
- 遺伝子が体の設計図であること
- 異常な設計図が病気の原因になること
- 正しい設計図に置き換えれば病気を改善できること
というシンプルな考えに基づいています。ここからは、遺伝子治療を理解するうえで重要なポイントを順番に見ていきましょう。
遺伝子治療の基本原理
遺伝子治療は、病気の原因となる異常な遺伝子を正すことを目的に、主に次の2つの方法で行われます。
- 欠損した遺伝子を補い、正常な機能を取り戻す
- 異常な遺伝子を修正し、誤った働きを止める
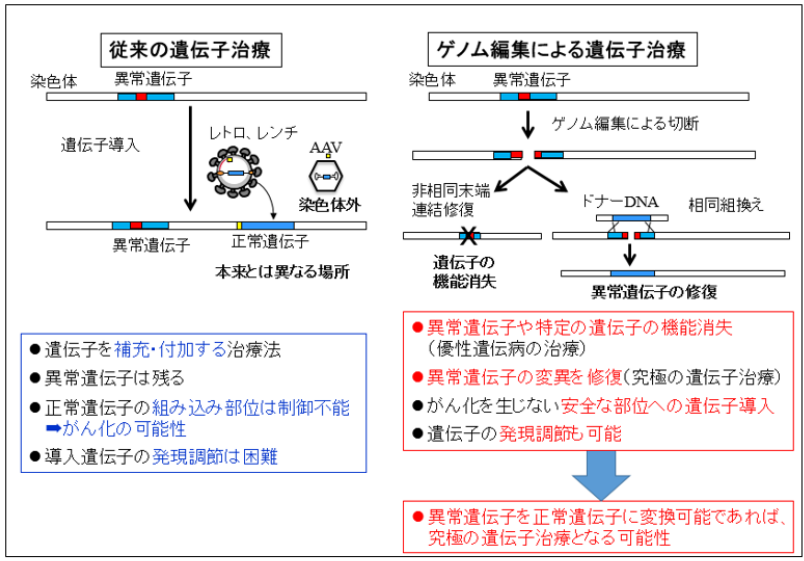
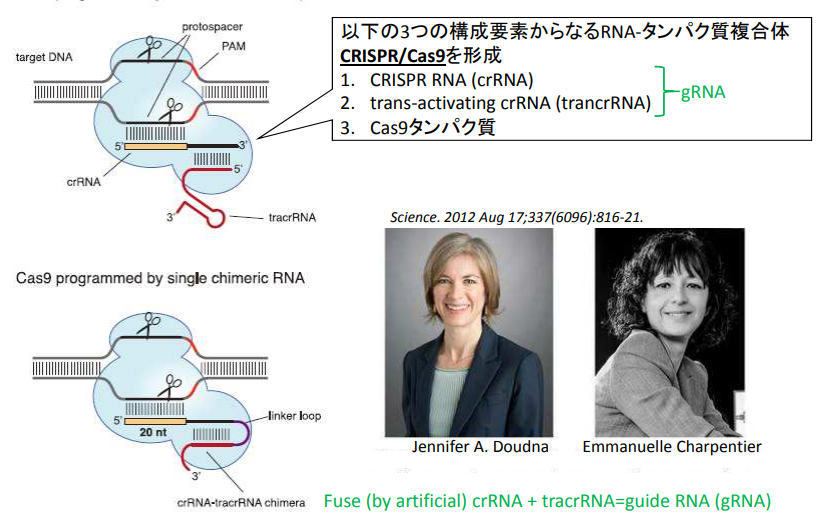
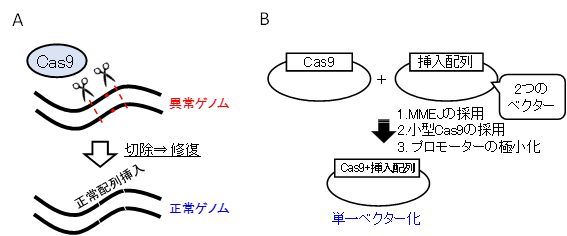
1990年代には「遺伝子を補う」治療が中心でしたが、近年はゲノム編集技術の進歩により、狙った遺伝子を精密に書き換えることが可能になりました。特に「CRISPR-Cas9」の登場は、治療の正確性と効率を飛躍的に高めることにつながっています。
この技術を開発したジェニファー・ダウドナ博士とエマニュエル・シャルパンティエ博士は、2020年にノーベル化学賞を受賞し、遺伝子治療の未来を大きく押し広げました。
「CRISPR-Cas9」
CRISPR-Cas9は「ガイドRNA」が編集したいDNA配列を正確に見つけ出し、「Cas9酵素」がその位置で二本鎖を切断する仕組みです。従来は数年かかった遺伝子ターゲティング設計が、ガイドRNA配列を変えるだけで数日〜数週間に短縮されました。
これにより研究コストも大幅に削減され、世界中の研究者が手軽に使える汎用ツールとして普及しました。狙った箇所だけを高精度に切る能力は、オフターゲットの低減や効率的な修復誘導を可能にし、根本治療の実用化を大きく前進させました。
ゲノム編集・遺伝子組み換えとの違い
遺伝子治療はしばしば「ゲノム編集」や「遺伝子組み換え」と混同されますが、目的と対象が異なります。
- 遺伝子組み換え:外部の遺伝子を導入して新しい性質を持たせる技術で、農業やバイオ産業で利用。
- ゲノム編集:既存の遺伝子の一部を削除・変更することで、生命の設計図を狙って修正する技術
遺伝子治療は、これらの技術を人間の医療に応用し、患者自身の遺伝子異常を正すことで病気を治療するものです。
つまり、共通して「遺伝情報を書き換える」点は同じでも、遺伝子治療は人を対象にするため、特に安全性や倫理的な配慮が強く求められるのです。
【遺伝子治療技術とゲノム編集技術の違い】
遺伝子治療の歴史と発展
遺伝子治療の研究は1980年代に始まり、1990年には米国で世界初の臨床治療が行われました。対象となったのは「ADA欠損症」※という先天的な免疫不全症で、正常な遺伝子を患者の細胞に導入することで免疫機能の改善が報告されました。
しかしその後、一部の臨床試験で副作用や死亡例が生じ、安全性への強い懸念が浮上しました。この経験を経て、研究者たちはより安全な遺伝子運搬方法(ベクター)※の開発に取り組み、非ウイルスベクターや新しい編集技術が登場しました。
近年では治療薬の承認も相次ぎ、実用化が加速しています。
中心人物と研究・企業の動向
遺伝子治療の発展には、多くの研究者と企業が関わってきました。臨床応用を初めて実現したW. French Anderson博士は「遺伝子治療の父」と呼ばれています。
技術革新の分野では前述のダウドナ博士らが「CRISPR-Cas9」の開発で重要な役割を果たし、近年は米国や欧州の製薬企業やスタートアップが新薬開発を牽引しています。また日本では、iPS細胞研究※と遺伝子治療を組み合わせた新しい戦略も模索されており、世界的な潮流の一角を担っています。
遺伝子治療は、遺伝子の異常を直接修正することで病気を根本から改善する先端医療です。歴史的には試行錯誤の連続でしたが、技術進歩により安全性や精度が大きく向上しました。いまや世界中で研究・臨床応用が広がりつつあり、21世紀の医療を象徴する技術となっています。
次の章では、具体的にどのような種類や仕組みで遺伝子治療が行われているのかを見ていきましょう。*1)
遺伝子治療の種類と仕組み
【遺伝子治療製造技術開発】
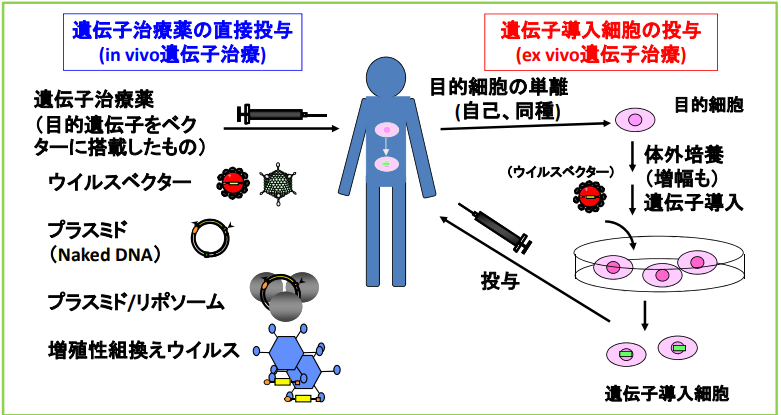
遺伝子治療は「体の設計図であるDNAを直接修正して病気を治す」という革新的な方法ですが、実際には複数の種類と仕組みがあり、病気の性質や治療目的によって異なるアプローチが選ばれます。体内に直接ベクター(運び役)を投与して遺伝子を送り込む方法から、いったん細胞を体外に取り出して遺伝子を組み込み、加工した細胞を再び体に戻す方法まで幅広く存在します。
ここでは、遺伝子治療の「種類」と「仕組み」を順番に整理して見ていきましょう。
遺伝子治療の種類
遺伝子治療は、治療対象となる細胞や影響範囲によって大きく2つに分けられます。
体細胞遺伝子治療
体細胞遺伝子治療は、皮膚・血液・肝臓など「体の細胞」に対して遺伝子を導入します。現在、世界中で実用化されているのがこの方法です。
患者本人だけに効果があり、子どもに遺伝することはありません。このため倫理的にも受け入れやすく、
- 血友病
- 重症免疫不全症
- 白血病治療
に使われるCAR-T細胞療法※などで成果が出ています。
生殖細胞系列遺伝子治療
生殖細胞系列遺伝子治療は精子・卵子・受精卵といった「次の世代につながる細胞」に遺伝子を導入する方法です。もし実施されれば子孫に変化が受け継がれるため、重大な倫理的・社会的問題があります。
中国でゲノム編集された双子が誕生した事例(2018年)は国際的な批判を呼び、この分野がいかに慎重な議論を必要とするかを示しました。現時点で臨床利用は世界的に禁止されています。
対象疾患による分類
さらに、どの病気を治すかによっても分類できます。
- 先天性疾患:生まれつきの遺伝子異常による病気(例:重症複合免疫不全症、筋ジストロフィー)
- 後天性疾患:生活の中で発症する病気(例:がん、心臓病、神経変性疾患)
特に先天性疾患では「欠けている遺伝子を補うだけで症状が劇的に改善する」ケースがあり、遺伝子治療が大きな成果をあげやすい分野です。
遺伝子治療の仕組み
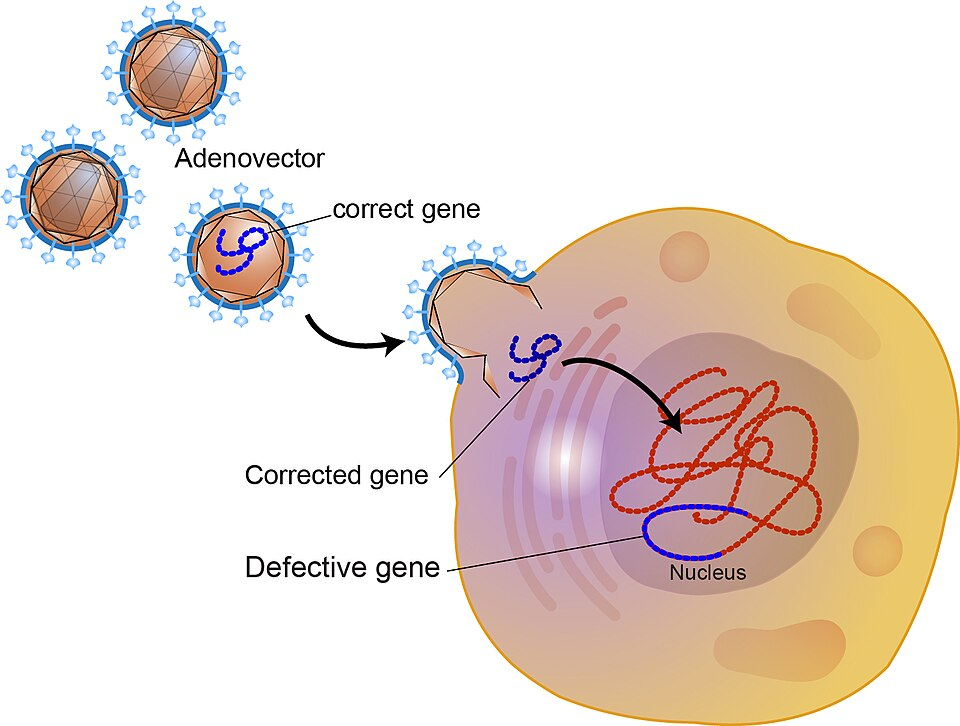
遺伝子治療を成功させるには、治療に必要な遺伝子を細胞まで正確に運び、体内で機能させる必要があります。この役割を担うのが「ベクター」と呼ばれる運び屋です。
ベクターの種類
①ウイルスベクター
もともとウイルスが持つ「細胞に入り込む力」を応用したもので、病気を起こす能力は取り除かれています。代表的なものには以下のような例があります。
- アデノ随伴ウイルス(AAV):安全性が高く、長期間の効果が期待できる
- レンチウイルス:分裂・非分裂細胞どちらにも使え、造血幹細胞治療などで活用
- アデノウイルス:一時的に遺伝子を働かせるのに有効だが免疫反応の注意が必要
- レトロウイルス:分裂している細胞に適しており、血液系の治療で用いられる
②非ウイルスベクター
人工的に作られた方法で、
- プラスミドDNA:細菌由来の環状DNA分子で、遺伝子導入のベクターとして利用
- 脂質ナノ粒子:脂質で包まれた微小カプセルで、mRNAワクチン※などの核酸を細胞内に運ぶ
などがあります。免疫反応が起きにくい一方、効率はウイルスベクターより劣ることが多いです。
治療の方法:in vivo と ex vivo
- in vivo法:
遺伝子を組み込んだベクターを直接体内に投与する方法です。静脈注射や脳内投与などがあり、血友病や神経疾患の治療で応用が進んでいます。 - ex vivo法:
患者の細胞を体外に取り出し、遺伝子を組み込んでから戻す方法です。CAR-T細胞療法が代表例で、がん細胞を攻撃する免疫細胞を作り出します。
ゲノム編集技術の活用
近年は「欠けた遺伝子を足す」だけでなく、「壊れた遺伝子を正しく修復する」方法も登場しました。その代表がCRISPR-Cas9です。2012年にジェニファー・ダウドナらが開発したこの技術は、狙ったDNAを切って修正できるため、より根本的な治療が可能となっています。
【CRISPR-Cas9】
遺伝子治療はゲノム編集技術の活用によって進化し続けています。複数の要素を組み合わせて一人ひとりに最適な方法を選ぶ時代が到来しており、今後の研究と社会的な議論が推進される分野です。*2)
遺伝子治療が注目されている背景
【遺伝子】
遺伝子治療がいま世界的に大きな注目を集めているのは、単なる医学の発展だけではありません。技術の革新、社会の変化、そして市場や政策の後押しといった複数の流れが重なり、この分野を「次世代医療の柱」として押し上げているのです。
「病気の原因となる遺伝子そのものを治す」という発想が、なぜ現実的な選択肢となってきているのか、その背景を整理してみましょう。
技術革新が引き起こした可能性の革命
最大の転機は、2012年に登場したCRISPR-Cas9という遺伝子編集技術です。この技術は「分子のはさみ」と呼ばれ、DNAを狙った場所で正確に切り取り修正できるのが特徴です。
従来は1つの遺伝子改変に数年かかり膨大な費用が必要でしたが、CRISPRによって数週間で可能となり、研究コストも大幅に削減されました。これにより、1990年代の臨床試験で死亡事故が起き停滞していた分野が一気に再び動き出し、2020年代には複数の治療薬が相次いで承認される「承認ラッシュ」の時代を迎えています。
高齢化社会が生む新たな医療ニーズ
もう一つの要因は社会の高齢化です。WHOは2040年までにアルツハイマー病やパーキンソン病といった神経変性疾患が、がんや心臓病に匹敵する死因になると予測しています。
これらは従来の薬では根治が難しい病気ですが、遺伝子治療なら原因遺伝子そのものに働きかけられる可能性があります。日本でも20年後には80歳以上が人口の1割を超えると見込まれ、治療法の革新は社会的な必然と言えるでしょう。
さらに、従来治療法のなかった希少疾患にも光が当たり、次世代シーケンサー※を用いた国の難病研究プロジェクトでは、遺伝子解析と臨床データを結びつけた新しい治療法の開発が進んでいます。
爆発的な市場成長と投資の集中
市場規模の拡大も見逃せません。世界の遺伝子治療市場は2025年に約75億ドルとされ、2033年には約293億ドルに達すると予測されています。年平均成長率は18%を超え、医薬分野でも有数の成長分野です。
これを背景に、アステラス製薬など大手企業が数千億円規模の投資を行い、大学発ベンチャーも次々に参入しています。投資件数は近年やや減少していますが、それは期待先行から実用化フェーズへと移行し、資金が有望な案件に絞られてきたことを意味します。
社会実装への期待と政策的な後押し
遺伝子治療は「医療の限界を超える手段」として社会課題の解決にも直結します。ある試算では、2034年までに100万人以上が遺伝子治療を受け、医療費総額は120億ドルを超えるとされています。
日本でも経済産業省が再生医療や遺伝子治療を重点産業と位置づけ、2030年まで年率30%以上の成長を見込む戦略を掲げています。こうした政策的な後押しは、研究者や企業の活動をさらに加速させる力となっています。
遺伝子治療への注目は、技術革新による「可能性の革命」、高齢化社会がもたらす「医療ニーズの変化」、そして市場と政策の「強力な後押し」が重なった結果といえます。次の章では、この新しい医療がもたらす具体的なメリットを見ていきましょう。*3)
遺伝子治療のメリット
【Cas9による遺伝子治療】
従来の医療では不可能だった「病気の原因そのものを修正する」遺伝子治療は、医療と社会に大きな変革をもたらしつつあります。その具体的なメリットを多角的に見ていきましょう。
根本治療による劇的な効果
遺伝子治療は、症状を抑える従来療法とは異なり、病気の原因となる遺伝子異常を直接修正します。例えば重症複合免疫不全症(SCID)の臨床試験では、多くの患者で免疫機能が正常域まで回復しました。
また、視覚障害マウスへの治療で光感度が劇的に改善した事例も報告されており、「失われた機能を回復できる」ことを実証しています。
一度の治療で持続する効果と経済性
遺伝子治療は、一度の投与で長期間にわたり効果が期待できる点も大きな強みです。脊髄性筋萎縮症に使われる「ゾルゲンスマ」※は高額な薬剤ですが、長期的には従来の継続治療よりも医療費を抑えられる可能性があります。
世界的に医療費の増加が懸念される中で、持続的効果を持つ治療は社会全体の医療費負担軽減にもつながります。
個別化医療の実現
患者ごとの遺伝子情報に基づき、最適な治療法を選べるのも遺伝子治療の魅力です。がん領域では、腫瘍の遺伝子変異を解析して薬を選ぶ「遺伝子プロファイル治療」が進んでおり、副作用を減らしつつ高い治療効果を狙えます。
こうしたアプローチは患者の生活の質を高め、社会復帰を早める点でも重要です。
従来不可能だった疾患への新しい道
これまで有効な治療法がなかった希少疾患や難治性疾患にも、遺伝子治療は可能性を開いています。代表例が白血病やリンパ腫に用いられるCAR-T細胞療法で、化学療法が効かなかった患者にも成果を示しています。
さらに神経疾患や眼科疾患など幅広い分野で臨床研究が進み、患者にとって大きな希望となっています。
遺伝子治療のメリットは、患者の治療効果にとどまらず、医療制度や社会の持続性にも影響を与える可能性を秘めています。次の章では、こうした期待の一方で浮かび上がる課題や問題点についても知っておきましょう。*4)
遺伝子治療のデメリット・問題点

画期的な可能性を秘めた遺伝子治療ですが、その強力さゆえに避けて通れない重要な課題も多く存在します。安全性への懸念、高額な治療費、倫理的な問題、制度整備の遅れなど、これらの問題点を理解することは、この技術を社会が適切に受け入れるために重要です。
安全性の問題
まず最も深刻なのが安全性の問題です。生命の設計図であるDNAを直接操作するため、予期しない健康被害が完全には排除できません。
実際、1999年に米国で行われた臨床試験では18歳の患者が治療用ウイルスへの免疫反応で死亡し、2000年頃には免疫不全症治療で複数の患者が白血病を発症しました。「オフターゲット効果」という、狙った遺伝子以外を誤って編集してしまう現象も大きなリスクとなっています。
高額な治療費
次に、極めて高額な治療費の問題があります。脊髄性筋萎縮症向けの「ゾルゲンスマ」は1回2億円超と「世界で最も高額な医療」の一つです。
希少疾患を対象とするため開発費負担が大きく、経済格差により治療を受けられる患者が限られる深刻な医療格差を生んでいます。
倫理面での課題
倫理面では、「どこまでが治療で、どこからが人間改良なのか」という境界線が曖昧な点が問題視されています。2018年の中国「ゲノム編集ベビー」事件は、安全性未確立の段階での遺伝子改変の危険性を世界に示しました。
将来的に次世代に影響する生殖細胞治療が検討される可能性もあり、社会的合意の形成が急務となっています。
法的制度整備の遅れ
さらに、新技術ゆえの制度整備の遅れも課題です。国によって承認プロセスが異なり、患者が海外で未承認治療を受ける「医療ツーリズム」も発生しています。治療施設も世界的に限られ、地域格差も深刻です。
これらの課題は技術の革新性の裏返しでもあります。ここで挙げたような課題に社会全体で取り組むことで、遺伝子治療の真の価値を多くの人が享受できる未来が実現するでしょう。*5)
日本における遺伝子治療の現状

世界の遺伝子治療分野において、日本は質の高い基礎研究を誇りながらも、実用化の面では欧米に一歩遅れをとっているのが現状です。しかし近年、iPS細胞技術という独自の強みを活かし、官民一体となった大規模投資によって、その差を埋め、巻き返しを図る動きが本格化しています。
ここでは、日本の現状と未来への展望を確認していきましょう。
承認薬の現状と臨床開発の課題
2025年現在、日本国内で承認されている遺伝子治療薬は約10製品に上ります。脊髄性筋萎縮症治療薬「ゾルゲンスマ」に加え、血液がんに対しては「キムリア」「イエスカルタ」など複数のCAR-T細胞療法が実用化され、対象疾患は着実に広がっています。
しかし、その一方で臨床開発の規模には大きな課題があります。日本で実施されている遺伝子治療の臨床試験数は全世界の約1.5%に過ぎず、数千件に上る欧米とは大きな隔たりがあります。この「臨床開発の遅れ」が、承認薬数の差となって表れているのが実情です。
世界をリードする研究開発とiPS細胞技術
日本の遺伝子治療における最大の強みは、山中伸弥教授が樹立したiPS細胞(人工多能性幹細胞)技術と、ゲノム編集技術を融合させた独創的な研究開発にあります。患者自身のiPS細胞を活用して遺伝子を修復し、体内に戻すアプローチは、拒絶反応の少ない理想的な治療法として世界中から注目されています。
この「iPS細胞 × ゲノム編集」という日本独自の強みを活かし、いかにして臨床開発へと繋げていくかが、今後の国際競争力を左右する鍵となります。
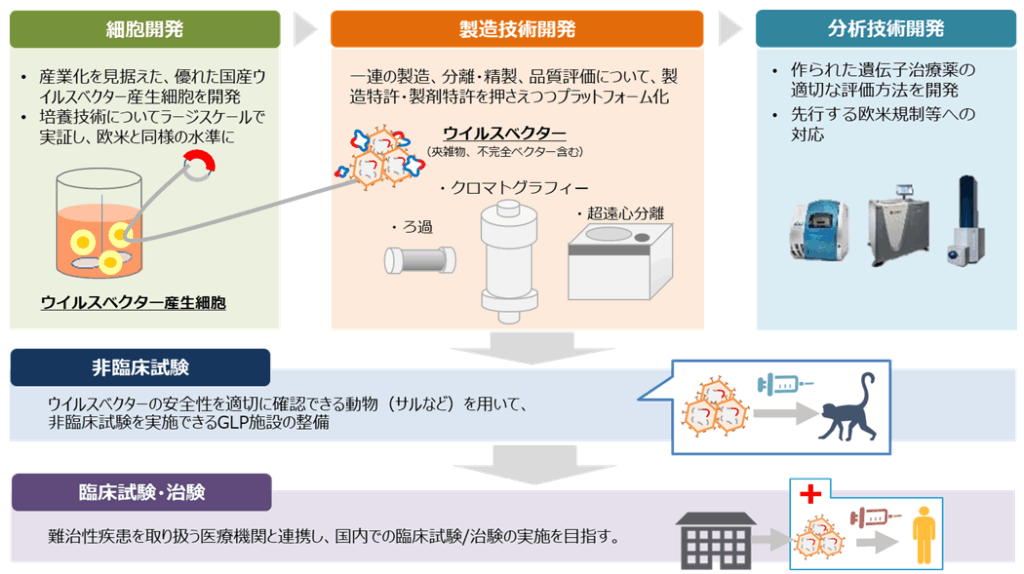
官民一体で進む製造・社会基盤の強化
臨床開発の遅れを克服するため、日本政府は近年、支援を大幅に強化しています。特に、2024年度から始まった総額383億円規模の補助金事業は、遺伝子治療薬の製造を受託するCDMO企業※の国内製造基盤を抜本的に強化するものです。
この動きに呼応し、AGCやニコンといった大手企業も合計1,000億円超の設備投資を計画しており、日本の製造能力は飛躍的に向上する見込みです。また、日本遺伝子細胞治療学会が専門医の認定制度を設けるなど、質の高い医療を安全に提供するための社会基盤整備も進められています。
研究開発のハードルとなる高額なベクター製造コストや研究資金不足といった課題に対し、官民一体で立ち向かう体制が整いつつあります。
日本の遺伝子治療は、臨床開発の数でこそ欧米に遅れをとっているものの、iPS細胞という世界に誇る研究の種を持っています。近年始まった製造基盤への大規模な集中投資によって課題を克服し、独自の強みを製品化へと繋げることで、今後、世界のトップランナーへと躍進する大きな可能性を秘めています。*6)
遺伝子治療とSDGs

遺伝子治療技術とSDGsは、「誰一人取り残さない」社会の実現と、これまで治療困難だった病気に苦しむ人々への希望をもたらすという共通の理念を持っています。生命の設計図そのものに働きかけるこの革新的な技術は、根本治療により医療格差の解消と持続可能なヘルスケア体制の構築に貢献する可能性を秘めています。
SDGs目標3:すべての人に健康と福祉を
遺伝子治療がSDGs達成において最も直接的に貢献するのが、目標3「すべての人に健康と福祉を」です。従来の医療では治療不可能だった遺伝性希少疾患に対し、根本的な治療法を提供することで、これまで「見放されてきた」患者たちに健康を取り戻す機会をもたらします。
脊髄性筋萎縮症に対するゾルゲンスマのような治療薬は、これまで数年で生命を失っていた患者に正常な成長と発達の機会を提供し、全ての人々が生涯にわたり健康的な生活を営める社会の実現に貢献しています。CAR-T細胞療法のように一度の治療で長期間の効果が期待できる点も重要で、患者のQOL向上と医療費削減の両立を実現します。また、mRNA技術を活用した新型コロナワクチンの成功は、感染症対策における遺伝子技術の有効性を実証し、将来のパンデミック対策への応用可能性を示しました。
SDGs目標9:産業と技術革新の基盤をつくろう
遺伝子治療は技術革新による産業基盤の強化にも重要な役割を果たします。バイオテクノロジー分野における技術革新の基盤を形成し、新たな産業エコシステムの創出につながっています。
世界の遺伝子治療市場は年平均30%以上の急成長を続けており、研究開発から製造、物流まで幅広い分野で雇用創出と技術蓄積が進んでいます。日本でも製造基盤整備への大規模投資により、CDMO産業(医薬品製造受託企業)の発展と国際競争力の強化が図られています。
SDGs目標10:人や国の不平等をなくそう
遺伝子治療技術の普及は、医療アクセスの格差による治療機会の不平等解消に重要な役割を果たします。これまで「希少疾患」と呼ばれ治療薬開発が困難だった疾患に対し、遺伝子治療技術の発展により、これまでなかった治療選択肢が生まれています。
患者数が少なく、製薬企業にとって経済的メリットが限定的だった疾患でも、遺伝子治療のプラットフォーム技術により効率的な開発が可能になり、医療における「取り残された人々」への支援が実現しつつあります。iPS細胞技術と遺伝子治療の組み合わせにより、患者自身の細胞を使った拒絶反応の少ない治療法の開発も進んでおり、臓器移植ドナー不足による治療格差の解消にも貢献が期待されています。
このように、遺伝子治療はSDGsの理念である「誰一人取り残さない」社会の実現に向けて、健康格差の解消、技術革新による産業発展を通じて多面的に貢献し、2030年までの目標達成をより現実的なものとする重要な技術として位置づけられています。*7)
>>SDGsに関する詳しい記事はこちらから
まとめ
【「ベクター」が正常な遺伝子を必要な細胞に運ぶイメージ】
遺伝子治療は、病気の原因となる遺伝子異常を直接修正する革新的な医療技術として、人類の健康に新たな地平を開きつつあります。CRISPR-Cas9をはじめとする技術革新により、これまで治療不可能だった疾患への根本的なアプローチが現実のものとなり、患者一人ひとりに最適化された治療の提供が可能になっています。
世界の遺伝子治療市場は年平均18%を超える成長を続け、2033年には約300億ドル規模に達すると予測される中、技術の可能性と同時に治療アクセスの格差という課題も浮き彫りになっています。
この技術の普及により、これまで見放されてきた希少疾患患者に希望をもたらす一方、現在、遺伝子治療は先進国の都市部に集中し、地方や途上国の患者は高額な費用と地理的制約により治療機会から排除されがちです。さらに、1回数億円という治療費は、多くの国の患者にとって現実的ではなく、経済格差が生命に直結する深刻な問題となっています。
私たちには、この革新的技術について正しい知識を身につけ、その可能性と限界を理解する責任があります。個人レベルでも、科学的根拠に基づいた情報を収集し、遺伝子治療に関する社会的議論に参加することで、適切な技術活用と公平なアクセスの実現に貢献できます。
あなたは、この技術が全世界の人々にとって真に平等で安全なものとなるために、どのような社会システムが必要だと考えますか。そして、技術の恩恵と責任をバランス良く分かち合う未来を、どのように実現できるでしょうか。
遺伝子治療の発展は、私たち一人ひとりの関心と行動にかかっています。この技術が持つ希望の光を、世界中のすべての人に届けられる持続可能で公正な医療システムの構築を目指していきましょう。*8)
<参考・引用文献>
*1)遺伝子治療とは
内閣府『ゲノム編集技術等について』
厚生労働省『ゲノム編集技術を用いた遺伝子治療用製品等の品質・安全性等の考慮事項に関する報告書』(2020年2月)
厚生労働省『再生医療・遺伝子治療等について』
中外製薬『遺伝子治療とは?』
MSD『遺伝子治療』(2023年6月)
日本医療研究開発機構『遺伝子治療とは』
*2)遺伝子治療の種類と仕組み
経済産業省『再生・細胞医療・遺伝子治療』
厚生労働省『ゲノム編集技術の概要と問題点』(2017年4月)
国立成育医療研究センター『わかる遺伝子細胞治療 一般向け参考資料』
医薬品医療機器総合機構『標的特異性を有するin vivo遺伝子治療用製品のベクターに関する評価の考え方専門部会』
遺伝子細胞治療学会『遺伝子細胞治療の定義と歴史』(2023年9月)
Corning『遺伝子導入ツールの比較|アデノ随伴ウイルスベクターとレンチウイルスベクター』
*3)遺伝子治療が注目されている背景
国立国際医療センター『ゲノム医療って何?』
MIT TECHNOLOGY REVIEW『CRISPR技術の進歩、誰もが遺伝子治療を受ける時代はやってくるか?』(2023年1月)
薬事日報『遺伝子治療とは?2025年の最新動向と今後の展望』(2025年9月)
難病医学研究財団/難病情報センター『次世代遺伝子解析装置を用いた難病の原因究明、治療法開発プロジェクト』
日本経済新聞『TPCマーケティングリサーチ、再生医療・遺伝子治療製品市場について調査結果を発表』(2025年4月)
*4)遺伝子治療のメリット
日本医療研究開発機構『ゲノム編集を用いた革新的な遺伝子治療による視覚再建―遺伝子変異を正常化する遺伝子治療の実現へ―』(2020年1月)
厚生労働省『再生医療等製品の価格算定に対する意見』(2023年7月)
経済産業省『再生医療・遺伝子治療の産業化に向けた基盤技術開発事業中間評価/終了時評価 補足説明資料』(2023年3月)
東北大学『個別化医療とは?』
*5)遺伝子治療のデメリット・問題点
厚生労働省『ゲノム編集技術等を用いたヒト受精胚等の臨床利用のあり方に関する専門委員会議論の整理』(2020年1月)
医薬品医療機器総合機構『遺伝子治療用製品等の非臨床安全性評価』
日本医学連合会『2.4 ゲノム編集の技術的課題』
Nature『遺伝子治療:AAV遺伝子治療の長期的な安全性に懸念』(2020年11月)
*6)日本における遺伝子治療の現状
医薬品医療機器総合機構『ゲノム編集技術を用いた遺伝子治療用製品等の品質・安全
性等の考慮事項に関する報告書
首相官邸『再生・細胞医療・遺伝子治療開発協議会検討状況説明資料』(2024年5月)
薬事日報『経産省設備投資補助、13件を採択-再生医療CDMO整備へ』(2025年7月)
日本経済新聞『先端医薬の国内生産整備 1000億円超投資 iPSや遺伝子 ニコン・AGC、政府も支援』(2025年7月
日本医療研究開発機構『再生医療・遺伝子治療の産業化に向けた基盤技術開発事業』
*7)遺伝子治療とSDGs
国際連合広報センター『すべての人に健康と福祉を』
厚生労働省『国連の持続可能な開発目標 3(SDG3)‐保健関連指標における日本の達成状況の評価および国際発信のためのエビデンス構築に関する研究』(2020年5月)
大阪大学『遺伝子治療および分子標的創薬による難病治療への取り組み (Gene therapy and molecular targeted drug discovery for the treatment of intractable diseases)』(2021年5月)
世界経済フォーラム『Accelerating Global Access to Gene Therapies:Case Studies from Lowand Middle-Income Countries』(2022年10月)
*8)まとめ
WIKIMEDIA COMMONS『NHGRI-85172』
経済産業省『令和6年度補正予算「再生・細胞医療・遺伝子治療製造設備投資支援事業費補助金」に係る間接補助事業者の採択結果について』(2025年7月)
Grand View Research『GVR Report cover Gene Therapy Market (2024 – 2030)』
科学技術振興機構『日本の科学技術・イノベーション政策の動向(2025 年)』(2025年3月)
日本経済新聞『がんゲノム検査で最適治療「10万人中7000人」 普及に財政の壁』(2025年8月)
この記事を書いた人
松本 淳和 ライター
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。