遺伝子診断は、私たちの健康と未来を左右する革新的な技術として医療現場に浸透していますが、その仕組みや実際にわかることを正確に理解している人は多くありません。個別化医療の実現から予防医療まで幅広い可能性を秘めている一方で、プライバシーや差別といった問題点も抱えています。
技術の進歩が加速する今だからこそ、今後さらに発展する遺伝子診断の仕組みや、これによってわかること、問題点などを確認しておきましょう。
目次
遺伝子診断とは
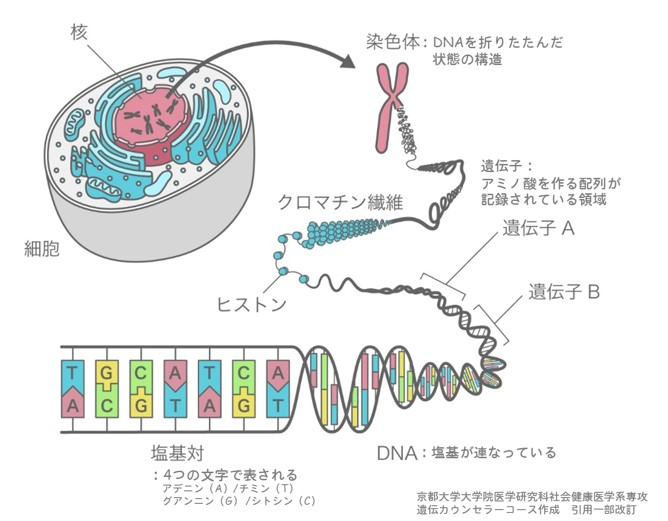
【遺伝子とDNA】
遺伝子診断は、私たちの身体の設計図である遺伝情報を解析し、病気の診断や将来のリスク、個々の体質などを明らかにする医療技術です。個人の遺伝的特徴に合わせた「個別化医療」が現実のものとなる中で、この技術は中心的な役割を担っています。
遺伝子診断の全体像を掴むために、まずはその根幹をなす基本的な知識から見ていきましょう。
遺伝子・DNA・ゲノム:身体の設計図を読み解く
遺伝子・DNA・ゲノムという3つの言葉を正しく使い分けることが、診断の内容を正確に理解する第一歩となります。
- DNA:遺伝情報を記録する化学物質
- 遺伝子:DNAその中で特定の機能を持つ部分
- ゲノム:ある生物が持つ全遺伝情報の一式
ヒトのゲノム配列は99.5%以上が共通ですが、残りのわずかな違いが体質などの個人差を生み出しており、遺伝子診断ではこの個人差に注目します。
遺伝子診断の目的と種類:何のために調べるのか
遺伝子を対象とする検査は多岐にわたります。代表的な検査には以下のようなものがあります。
- 病原体遺伝子検査:ウイルスや細菌など外部から侵入した病原体の遺伝情報を検出して感染の有無や型を調べる検査
- 体細胞遺伝子検査:がん細胞など体細胞に生じた後天的な遺伝子異常を解析し、治療方針や予後を評価する検査
- 遺伝学的検査:生まれ持った生殖細胞系列の遺伝情報を分析し、単一遺伝子疾患や遺伝性がん、リスク要因を評価する検査
- 新生児マススクリーニング:生後間もない乳児を対象に血液で先天性代謝異常症などの遺伝疾患を早期発見する検査
- 発症前診断:妊娠中の胎児や将来発症前の成人に対して、遺伝子異常の有無から疾患リスクを予測する検査
- 薬理遺伝学検査:薬物代謝や薬効に関わる遺伝的多型を調べ、個人ごとに最適な薬剤選択と投与量を導く検査
遺伝情報が持つ特別な性質と向き合い方
遺伝情報は、一度分かれば生涯変わることがなく、また血縁者とも一部共有されているという特徴を持ちます。そのため、就職や保険加入などで不当な差別につながらないよう、厳格な倫理的配慮が求められます。
実際に、米国では2008年に「遺伝情報差別禁止法(GINA法)」が制定され、遺伝情報を理由とした差別を禁じるなど、世界的にルール作りが進められています。
遺伝子診断の基礎知識は、この先進的な医療と適切に向き合うための羅針盤となります。技術は今後も急速に進歩し、さらに多くのことが遺伝情報から分かるようになるでしょう。*1)
遺伝子診断の仕組み
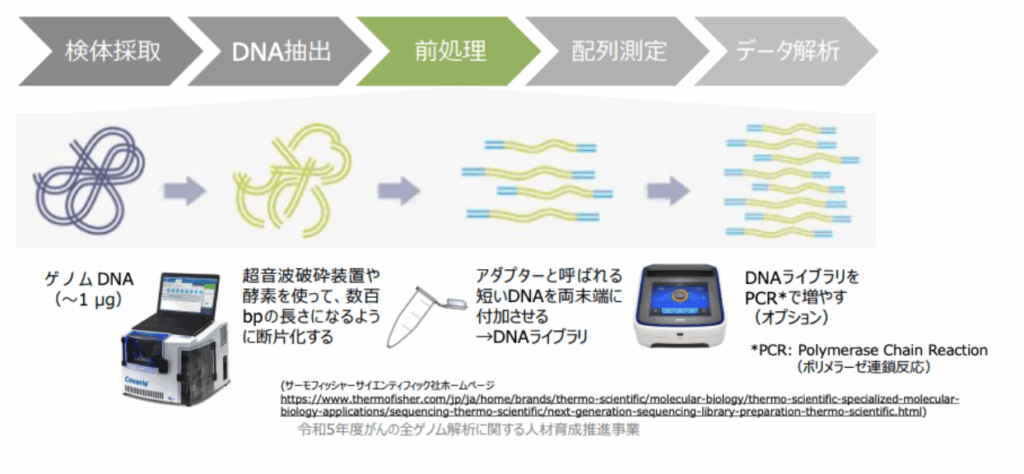
【NGS解析の準備】
遺伝子診断技術は、生物学、化学、情報科学が融合した複数の基盤技術の組み合わせによって成り立っています。ここでは、その一連の流れを具体的な技術と合わせてみていきましょう。
検査の第一歩:DNAの準備と増幅(PCR法)
すべての遺伝子診断は、血液や唾液などの検体からDNAを純粋な形で取り出す「抽出」作業から始まります。しかし、抽出されたDNAはごく微量であるため、そのままでは解析が困難です。
そこで重要な役割を果たすのが、1983年にキャリー・マリス博士(1993年ノーベル化学賞受賞)によって発明されたPCR法です。PCR法は、解析したい特定のDNA領域だけを選んで、数百万から数十億倍に増幅する画期的な技術です。
PCR法では、温度を周期的に変化させることで、DNAの二本鎖を分離させ、設計図のコピーを指数関数的に増やしていきます。この技術のおかげで、ほんのわずかな検体からでも、解析に必要な量のDNAを確保することが可能になりました。
感染症の診断から遺伝病の検査まで、現代の遺伝子解析に欠かせない基盤技術です。
遺伝情報を読む技術:シークエンシングの進化
増幅されたDNAから遺伝情報を直接読み取る核心的な技術が「シークエンシング」です。これは、DNAを構成するA・T・G・Cという4種類の塩基の並び順を決定するプロセスで、時代と共に大きく進化してきました。
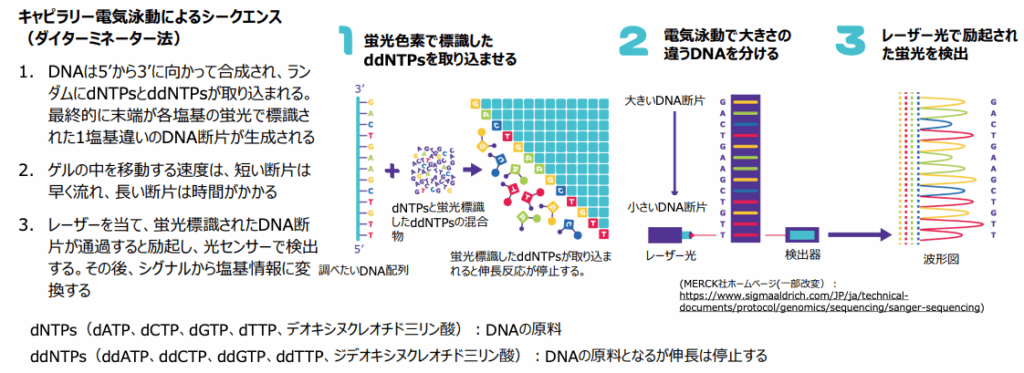
サンガー法:高精度な標準技術
1977年にフレデリック・サンガー博士(1980年ノーベル化学賞受賞)が開発したサンガー法(ダイターミネーター法)は、長年にわたりDNA解析の標準とされてきた技術です。化学反応を利用してDNAの複製を特定の場所で止め、その断片の長さを調べることで、一文字ずつ正確に塩基配列を決定します。
サンガー法は非常に高い精度を誇り、現在でも特定の遺伝子の変異を確定させる際などに用いられています。
【サンガーシークエンス(ダイターミネーター法)】
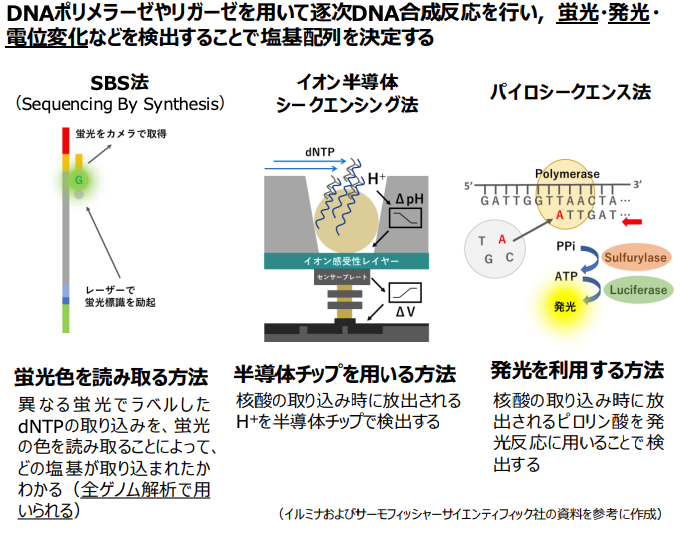
次世代シークエンサー(NGS):高速・大量解析の実現
2000年代半ばに登場した次世代シークエンサー(NGS)は、遺伝子解析に革命をもたらしました。サンガー法が「一冊の本を丁寧に一文字ずつ読んでいく」のに例えられるなら、NGSは「図書館中の本を同時にコピーし、並行して読み進める」ようなものです。
数百万ものDNA断片を同時に解析することで、ヒト一人の全ゲノム情報をわずか数日で読み解くことを可能にし、コストを劇的に引き下げました。
【次世代シークエンス】
多角的な解析と情報の解釈
塩基配列を読み取っただけでは、診断は完了しません。その配列が何を意味するのかを解釈し、他の角度からも検証するプロセスが続きます。
バイオインフォマティクス:膨大なデータの意味付け
NGSから出力されるのは、膨大な塩基配列の生データです。この「文字の羅列」を、標準的なヒトゲノム配列と比較し、医学的に意味のある違い(バリアント)を見つけ出すのが「バイオインフォマティクス(生命情報科学)」です。
世界中のデータベースや論文を参照しながら、発見された遺伝子の違いが病気の原因となりうるかを評価する、まさに診断の頭脳ともいえる工程です。
FISH法:染色体レベルでの可視化
シークエンシングが「文字」を読む技術なら、染色体という「巻物」全体で大きな変化が起きていないかを確認する技術もあります。その一つがFISH法です。
蛍光物質で目印を付けた探針(プローブ)を使い、特定の遺伝子が染色体上の正しい位置に存在するか、数は正常かなどを顕微鏡で直接観察します。特に、がん細胞でしばしば見られる染色体の大きな構造異常の検出に力を発揮します。
このように遺伝子診断は、PCR法による「増幅」、シークエンサーによる「読解」、そしてバイオインフォマティクスやFISH法などによる「解釈・検証」という、複数の専門技術が連携することで成り立っています。これらの技術革新が、現代の個別化医療を支えているのです。*2)
遺伝子診断でわかること
遺伝子診断は、病気の確定診断から将来のリスク評価、さらには個々の体質に至るまで、健康に関する様々な情報を私たちに教えてくれます。その情報は、単一の明確な答えを示すものから、将来の可能性を示唆するものまで多岐にわたります。
ここでは、遺伝子診断で主に「なにがわかるか」を見ていきましょう。
原因が明確な病気の診断と早期発見
遺伝子診断が最も直接的に力を発揮する分野の一つが、特定の一つの遺伝子の変化が主な原因で発症する病気の診断です。これらは「単一遺伝子疾患」と呼ばれます。
以下がその代表的な例です。
- ハンチントン病:神経細胞が徐々に破壊される進行性の遺伝性疾患
- フェニルケトン尿症:フェニルアラニン代謝酵素の欠損による先天性代謝異常症
- デュシェンヌ型筋ジストロフィー:筋細胞の変性・壊死が進行する遺伝性筋疾患
- 血友病:血液の凝固因子の遺伝的異常で出血しやすくなる疾患
- 嚢胞性線維症:全身の粘液分泌異常による呼吸器・消化器症状を示す遺伝病
- 家族性大腸腺腫症:大腸に多数のポリープができる腫瘍性疾患
- マルファン症候群:結合組織の異常による全身の臓器障害が見られる疾患
- 成人型多発性嚢胞腎:腎臓に多数の嚢胞が生じて腎機能障害を起こす遺伝病
将来の病気への「かかりやすさ」の評価
すべての病気が、一つの遺伝子だけで決まるわけではありません。糖尿病や高血圧、多くのがんといった一般的な疾患は「多因子疾患」と呼ばれ、複数の遺伝的要因と、食生活や運動習慣、喫煙といった環境要因が複雑に絡み合って発症します。
この分野における遺伝子診断は、「あなたは将来この病気になる」と断定するものではなく、あくまで遺伝的な「かかりやすさ(疾患リスク)」を確率として評価するものです。生まれ持った遺伝的特徴を知ることは、自身にとって特に注意すべき生活習慣を明確にし、より効果的な予防行動へと繋げるための貴重な手がかりとなります。
薬の効果や副作用といった「体質」の解明
私たちの体質は、病気へのかかりやすさだけでなく、薬に対する反応の仕方にも影響します。同じ薬を同じ量だけ服用しても、効果が絶大な人もいれば、重い副作用に苦しむ人がいるのはそのためです。
このような薬に対する反応性の個人差を、遺伝情報を基に解明するのが「ファーマコゲノミクス(ゲノム薬理学)」です。例えば、薬を体内で分解する酵素の働きは遺伝的に決まっており、その働きが強いか弱いかによって、薬が効きすぎたり、逆に効かなかったりします。事前に遺伝子を調べることで、個々の患者にとって最適な薬の種類や量を判断し、治療効果の最大化と副作用の最小化を目指す「個別化医療」の実現に欠かせない情報となります。
このように、遺伝子診断から得られる情報は非常に多様です。これらの医学的意味合いを正しく理解し、ご自身の健康管理に役立てていくためには、専門家による適切な情報提供やカウンセリングを受けることが重要です。*3)
遺伝子診断のメリット

自らの遺伝情報を知ることは、私たちの健康管理や医療との向き合い方に大きな可能性をもたらします。遺伝子診断がもたらす具体的なメリットについて、いくつかの側面に分けて見ていきましょう。
疾患の予防や早期発見に繋がる
遺伝子診断がもたらす最大のメリットの一つは、病気に対する「先手」を打てるようになることです。
遺伝性乳がん卵巣がん症候群(HBOC)のように発症リスクが極めて高いと判明した場合、予防的な手術や、通常より頻度の高い精密な検診を受けるといった具体的な対策を講じることが可能になります。さらに、万が一発症しても最も治療しやすい初期段階で発見できる可能性が飛躍的に高まります。
また、生まれてすぐの赤ちゃんを対象に行われる「新生児マススクリーニング」は、早期発見が劇的な成果を上げる好例です。例えばフェニルケトン尿症という先天性の代謝異常症は、発見が遅れると重い知的障害に至りますが、早期に発見し特別なミルクで育てることで、発症をほぼ完全に予防できます。
最適な治療法の選択で「個別化医療」を実現する
遺伝情報は、病気になった際の治療においても強力な指針となり、「個別化医療(プレシジョンメディシン)」を実現する上で中心的な役割を果たします。
特にがん治療において、がん細胞の遺伝子を調べることで、そのがんの性質を決定づけている「弱点」を特定し、そこをピンポイントで狙い撃つ分子標的薬を選択できます。これにより、治療効果を最大化し、無効な治療による副作用や時間の損失を最小限に抑えることが可能になりました。
また、薬の効き方や副作用の出やすさに関わる遺伝的な体質を事前に知ることで、試行錯誤を減らし、最初から最も効果が期待できる薬を安全に使う手がかりとなります。
確定診断による精神的安堵と将来への備え
長年にわたり原因不明の症状に悩まされてきた人々にとって、遺伝子診断は希望をもたらす可能性があります。
様々な病院を巡っても原因がわからなかった、「診断がつかない病気」に対し、遺伝子診断が最終的な確定診断をもたらす事例は少なくありません。病名が分かることは、適切な治療法を探す第一歩となるだけでなく、「なぜ苦しんできたのか」という問いに答えを与え、大きな精神的な安堵に繋がります。
さらに、その遺伝情報が次世代にどう関わるかを正確に知ることは、出生前診断などを通じて、将来の家族計画を考える上での重要な判断材料となります。
遺伝子診断は、予防、治療、そして精神的な側面に至るまで、多岐にわたる恩恵をもたらします。遺伝情報を正しい形で効率的に活用することで、私たちはより賢明に自らの健康と向き合うことができるようになるのです。*4)
遺伝子診断のデメリット・問題点

遺伝子診断がもたらす多くの恩恵の裏側で、私たちはその情報が持つ特異性ゆえの課題や問題点も知っておく必要があります。遺伝子診断にも慎重に議論されるべき側面が存在するのです。
遺伝情報に基づく差別(遺伝子差別)のリスク
遺伝情報は、本人の努力とは無関係に将来の病気のかかりやすさを示唆するため、就職や保険加入の際に不利な扱いを受ける「遺伝子差別」に繋がる懸念が指摘されています。実際に、遺伝性疾患を理由に職場で不利益な発言を受けたり、医療現場で意図しない対応をされたりといった事例も報告されており、プライバシー保護と差別の防止は社会全体の大きな課題です。
知ることによる精神的負担と家族への影響
現時点で有効な治療法がない病気のリスクが高いと知った場合、その情報は生涯にわたって重い精神的な負担となる可能性があります。そのため、倫理的には「知らないでいる権利」も尊重されるべきだと考えられています。
また、一人の診断結果は血縁者のリスクも示唆するため、家族内で深刻な葛藤を生む原因となることも少なくありません。
結果の不確実性と解釈の難しさ
検査では、
- 病気との関連が不明な「VUS」と呼ばれる遺伝子の変化が見つかる
- 出生前診断の一部では偽陽性(異常がないのに陽性と判定される)の確率が高いものもある
など、不確実な結果が新たな混乱や不安をもたらす可能性があります。
このような専門的な情報を個人で正しく解釈することは難しく、誤った自己判断は不必要な医療行為や過度な安心に繋がる危険性もはらんでいます。
このように、遺伝子診断は複雑でデリケートな問題を内包しています。これらの課題と向き合い、適切な情報提供や遺伝カウンセリングといった支援体制を整えることが、技術の恩恵を社会全体で享受するために求められています。*5)
日本における遺伝子診断の現状と今後

世界中で進展する遺伝子診断の技術は、ここ日本でどのように医療現場へ導入され、どのような未来を描こうとしているのでしょうか。2023年の「ゲノム医療推進法」成立を大きな転換点として、国を挙げた取り組みが進む一方で、技術の急速な発展に社会の仕組みが追いついていくための課題も浮き彫りになっています。
日本の現状と、これから向かう先について見ていきましょう。
国の主導によるゲノム医療の推進と社会実装
現在の日本では、法律と制度の両面からゲノム医療を推進する基盤が着実に整えられています。
2023年に成立した「ゲノム医療推進法」は、国民が安心して質の高いゲノム医療を受けられる社会を目指す画期的な法律です。この法律に基づき国は、
- 研究開発の促進
- 医療提供体制の整備
- 遺伝情報による不当な差別の防止
に取り組むことが定められました。
その具体的な動きとして、特に「がん」の領域で社会実装が進んでいます。全国に「がんゲノム医療中核拠点病院」などが整備され、進行がんの患者などを対象に、数百の遺伝子を一度に調べる「がん遺伝子パネル検査」が公的医療保険のもとで広く行われるようになりました。
また、東北メディカル・メガバンク機構に代表される世界有数の「大規模バイオバンク」※が、日本人を対象とした研究開発を強力に後押ししています。
専門人材の育成と社会的ルールの構築という課題
最先端の技術が医療現場に導入される一方で、それを支える「人」と「ルール」の整備が今後の重要な課題となっています。
最も大きな課題の一つが、専門人材の圧倒的な不足です。遺伝子の専門家である臨床遺伝専門医や、複雑な検査結果の意味を分かりやすく伝え、患者さんや家族の意思決定を支援する「認定遺伝カウンセラー」の数は、増え続けるニーズに対して全く追いついていません。
また、ゲノム医療推進法で「差別の防止」が明記されたものの、その理念を実社会でどう機能させていくかという具体的なルール作りはこれからです。遺伝情報を理由とした就職や保険加入における不利益が生じないよう、誰もが安心して検査を受けられる社会的な環境を構築していく必要があります。
日本における遺伝子診断は、法整備と充実した研究基盤という強固な土台の上で、着実な一歩を踏み出しています。今後は、この流れを他の疾患領域にも広げつつ、技術の進歩を支える専門家の育成や社会的なルール作りといった課題を乗り越えていくことが、未来の医療の質を大きく左右することになるでしょう。*6)
遺伝子診断とSDGs

遺伝子診断は個人の遺伝情報に基づいた医療を実現する技術として注目されていますが、その本質は「誰もが平等に健康な生活を送る権利」を支える手段でもあります。SDGsが目指す「誰一人取り残さない」持続可能な社会の実現と、遺伝子診断が追求する個別化医療は、どちらも「すべての人々が最適な医療を受けられる未来」を目指しています。
遺伝子診断技術は特に、希少疾患や遺伝性疾患の診断・治療における格差解消や、途上国での基礎的保健サービスへのアクセス改善に大きく貢献する可能性を秘めています。関連の深いSDGs目標を見ていきましょう。
SDGs目標3:すべての人に健康と福祉を
遺伝子診断は、SDGs目標3の掲げる「あらゆる年齢のすべての人々の健康的な生活を確保し、福祉を促進する」の達成において中核的な役割を担います。特に、ターゲット3.8「ユニバーサル・ヘルス・カバレッジ(UHC)の達成」においては、個別化された医療サービスへの公平なアクセスを実現する重要な手段となります。
がん治療における遺伝子パネル検査の保険適用は、経済的負担を軽減しながら最適な治療選択を可能にしています。新生児スクリーニングによる先天性代謝異常症の早期発見は、適切な治療により重篤な症状を予防し、すべての子どもが健康に成長する機会を保障しています。
また、遺伝子診断技術の標準化と品質管理の確立により、医療の質を確保しながら途上国でも実施可能な診断システムの構築が進んでいます。これにより、地理的・経済的制約を超えて、世界中のより多くの人々が精密な診断と治療を受けられる環境が整備されつつあります。
SDGs目標10:人や国の不平等をなくそう
遺伝子診断は、SDGs目標10で目指す「各国内及び各国間の不平等を是正する」においても重要な貢献を果たします。特に、医療アクセスにおける格差の是正という観点で大きな意義を持ちます。
従来、希少疾患や遺伝性疾患の患者は「診断がつかない病気」に長期間苦しむことがありましたが、遺伝子診断により正確で迅速な診断が可能になりました。これは、疾患の種類や居住地域に関わらず、すべての患者が適切な医療を受ける機会の平等化につながっていきます。
国際的には、先進国で開発された遺伝子診断技術や治療法を途上国にも適用可能な形で提供するための取り組みが進められています。遺伝的多様性を考慮した診断システムの構築により、人種や民族による診断精度の格差解消も重要な課題として解決に向け取り組みが進んでいます。
個人の遺伝的特徴に基づく最適な医療の提供は、「誰一人取り残さない」というSDGsの理念に沿ったものです。今後は、技術へのアクセス格差の解消と、遺伝情報による新たな差別の防止に向けた取り組みが、SDGs達成のための重要な課題となります。*7)
>>SDGsに関する詳しい記事はこちらから
まとめ

遺伝子診断は、個人の遺伝情報(DNA)という身体の設計図を読み解き、病気の診断や将来のリスク、薬の効果といった体質を明らかにする技術です。個人に最適化された医療を実現する大きな可能性を秘めている一方で、差別や倫理的課題を伴うという側面にも理解が必要です。2025年現在、AIの統合によって解析精度と速度は飛躍的に向上し、全ゲノム解析のコストも数万円まで低下しましたが、これは同時に利用できる人とそうでない人との間に「アクセス格差」という新たな課題を生み出しています。
今後、この技術が本当の意味で「社会全体の恩恵」となるためには、国や経済状況、文化の違いを超えて誰もが安心して利用できる国際的なルール作りと、社会的な支援体制の構築が必要です。
私たち一人ひとりにできることは、まず正しい知識を身につけ、それを多角的な視点から理解することです。この革新的な技術を、私たちはどのような未来のために使うべきでしょうか。
その未来を選ぶのは専門家だけでなく、私たち一人ひとりの賢明な選択です。より良い明日を築くための一歩として、今後も新しい技術への理解を広げていきましょう。*8)
<参考・引用文献>
*1)遺伝子診断とは
国立がん研究センター『遺伝子検査(解析)』
厚生労働省『ゲノム医療施策に関する基本的な計画』(2025年2月)
厚生労働省『ヒトゲノム・遺伝子解析研究に関する倫理指針』(2008年12月)
慶応大学『遺伝子診断について』
日本医学会『医療における遺伝学的検査・診断に関するガイドライン』(2011年2月)
*2)遺伝子診断の仕組み
厚生労働省『がんの全ゲノム解析』(2024年)
厚生労働省『医療における遺伝子関連検査』(2016年1月)
文部科科学省『ゲノム医療実現バイオバンク利活用プログラム(B-cure)における取組』(2024年11月)
大阪健康安全基盤研究所『PCR ~発明と発展~』(2024年8月)
日本医師会『かかりつけ医として知っておきたい遺伝子検査、遺伝学的検査 Q&A』(2016年3月)
*3)遺伝子診断でわかること
WHO『Genomics』
南雲 明『薬物治療における個別化医療の現状と展望-基礎研究の進展が医薬品開発に与えるインパクト-』(2013年3月)
福岡県『先天性代謝異常検査(新生児マススクリーニング検査)』(2025年6月)
慶応大学『難病の原因究明に役立つ遺伝子診断』(2015年3月)
Kazusa DNA Research『遺伝学的検査リスト』
*4)遺伝子診断のメリット
日本医療政策機構『提言書:「がん個別化医療」の特質を踏まえた医療体制等の整備に向けて』(2022年9月)
MGenAid『遺伝子診断は病気の治療、予防にどう役立つ?』
The NEW ENGLAND JOURNAL of MEDICINE『決定分析 ― BRCA1 または BRCA2 変異を有する女性の余命に及ぼす予防的乳房切除術と卵巣切除術の効果』
内閣官房『超高齢社会における早期診断、早期介入の強化』(2017年7月)
中村 勝哉,関島 良樹『遺伝性神経疾患の遺伝カウンセリングと発症前診断』(2021年)
*5)遺伝子診断のデメリット・問題点
厚生労働省『ゲノム情報による不当な差別 難病の事例から見える課題』(2024年7月)
文部科学省『ヒトゲノムと人権に関する世界宣言』
医学書院『[第11回] 遺伝学の倫理』(2025年7月)
日本医学会『「遺伝情報・ゲノム情報による不当な差別や社会的不利益の防止」についての共同声明を公表』(2022年5月)
*6)日本における遺伝子診断の現状と今後
厚生労働省『がん診療連携拠点病院等』
内閣官房『ゲノム医療推進法に基づく基本計画及び全ゲノム解析等実行計画の進捗状況について』(2025年5月)
東京大学医科学研究所『BBJの試料と情報 -対象疾患/DNA/血清/ゲノムデータ/臨床情報』(2025年7月)
薬事日報『遺伝子治療とは?2025年の最新動向と今後の展望』(2025年9月)
*7)遺伝子診断とSDGs
PMC『Strengthening the Role of Genomics in Global Health』(2004年12月)
PMC『Towards equitable and trustworthy genomics research』(2022年2月)
日本医療研究開発機構『ゲノム医療におけるコミュニケーションプロセスに関する
ガイドライン』(2021年9月)
厚生労働省『令和8年度研究事業実施方針(厚生労働科学研究)』(2025年5月)
*8)まとめ
AI Front Trend『AI×ゲノム医療で未来の医療を実現!活用事例や最新動向を解説』(2025年3月21日)
NEWSCAST『遺伝子検査市場の動向、成長、将来の見通し』(2025年3月)
中外製薬『がんゲノム医療を治療の「当たり前」に』(2025年6月)
この記事を書いた人
松本 淳和 ライター
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。
生物多様性、生物の循環、人々の暮らしを守りたい生物学研究室所属の博物館職員。正しい選択のための確実な情報を提供します。趣味は植物の栽培と生き物の飼育。無駄のない快適な生活を追求。